点击蓝字 关注我们
在过去的十年里,受胃肠道问题困扰的人数显著增加,这一现象促使科研人员加大了对肠道的探究力度,包括探索宿主-微生物的相互作用、肠-脑轴的复杂联系,以及肠道微生物组对免疫健康的潜在影响等。我们今天要探讨的就是肠道通透性增加(亦称为“肠漏症”)这一现象,通常研究者们依赖于小鼠模型进行相关试验,但近年来,诸多创新方法的出现为我们提供了新的研究途径。
肠漏是什么
肠壁中紧密连接的小间隙允许水和营养物质通过,同时阻止有害物质的通过。当肠壁的紧密连接变得松散时,肠道变得更具渗透性,这可能会让细菌和毒素从肠道进入血液(图1)。这种现象通常被称为“肠漏”。
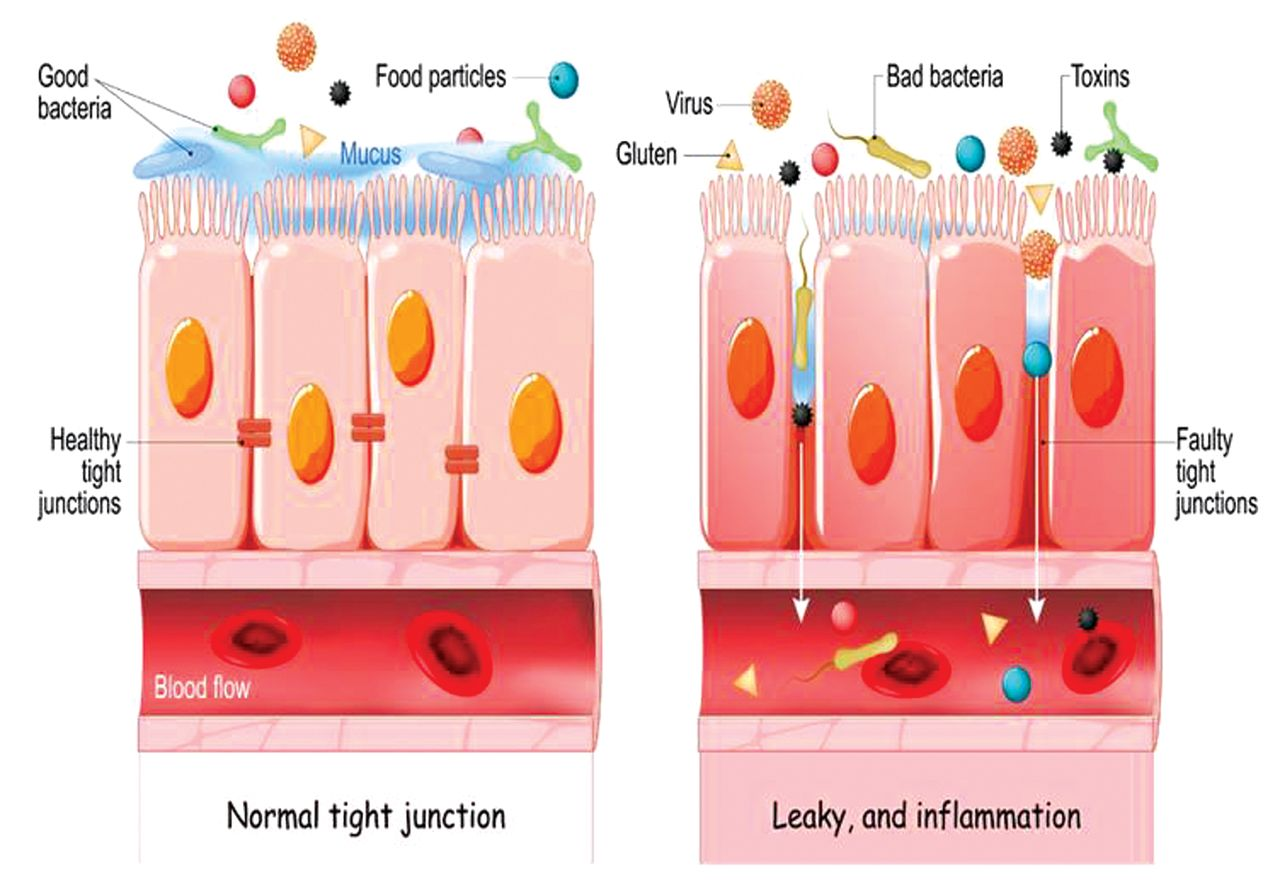
图1 肠漏示意图
肠漏的原因
肠漏可归因于刺激和炎症对肠道组织的消耗破坏,进而引发肠道组织的炎症反应。随着炎症的进一步加剧,组织开始坏死,细胞之间曾经紧密的连接开始形成缝隙,肠道屏障逐步失效。刺激的来源包括但不限于细菌和病毒感染、化疗和辐射、长期过度摄入酒精和非甾体抗炎药(如阿司匹林和布洛芬)以及不良食物(不仅指垃圾食品,还包括超加工食品和可能导致过敏反应的食物)。
肠漏会导致什么后果
炎症导致肠道紧密的缝隙连接屏障受损,从而使得有害物质得以透过肠屏障;进而导致各种轴(如肠-脑轴、肠-免疫轴和肠-心轴)被破坏(图2)[1,2]。此外,部分研究表示,进入肠道并移动到肝脏的恶性细菌可能诱发肝脏疾病[3]。
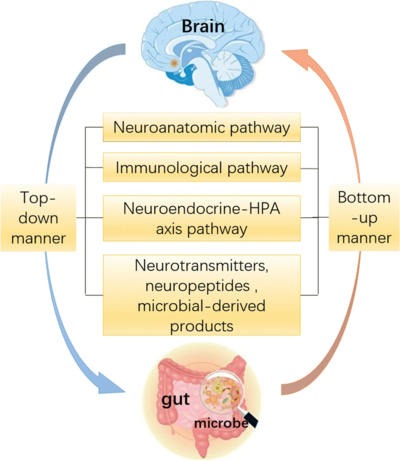
图2 A肠-肝轴与心血管风险 ;B肠-脑轴(GABA)是中枢神经系统和身体肠神经系统(ENS)之间的双向连接
如何检测肠漏
动物可以作为研究人类生理结构及机能的参考模型。在多数情况下,不同物种间的肠道屏障在结构和生化方面具有保守性[4],因此可以用动物作为实验模型,将动物暴露于肠道刺激物中,然后用荧光标记的葡聚糖右旋糖酐荧光素(FITC-Dextran)进行脉冲追踪,可以定量评估肠道通透性。在此,我们将向大家介绍两种便捷高效的非传统动物模型。
动物模型——秀丽隐杆线虫模型
秀丽隐杆线虫(Caenorhabditis elegans)是一个体内模型,并且体内微生物环境高度可控。秀丽隐杆线虫的肠道结构非常简单(图3)——它们的肠道仅由20个细胞组成[5],这使得秀丽隐杆线虫成为研究肠道屏障功能的优良模型。其肠道通透性由小肠上皮细胞调节,在肠漏过程中受到破坏[6]。有研究证实,针对秀丽隐杆线虫肠道炎症的有效治疗策略可以成功应用到小鼠模型上。这表明了尽管秀丽隐杆线虫的肠道结构过于简单,但研究获得的治疗方法仍具有应用于更复杂哺乳动物模型的潜力。当然,简单性也是线虫最大的局限性,因为线虫缺乏哺乳动物系统的特征,比如缺少肝脏的代谢过程。尽管如此,将线虫模型作为初步筛选工具,随后采用高等动物模型,有助于克服这一局限,提高研究效率,降低成本。
哺乳动物肠道上皮细胞之间的紧密连接是阻止大分子进入肠道的关键屏障。同样,秀丽隐杆线虫的上皮细胞也具备黏附复合物(图3)。研究表明,秀丽隐杆线虫上皮细胞的机制与哺乳动物细胞相似,因此其适用于模拟微生物生态失调、肠道炎症及肠道疾病发病机制[7]。线虫肠漏研究可关注上源生科微信公众号并发送“线虫肠漏”,即可自动获取相关论文。
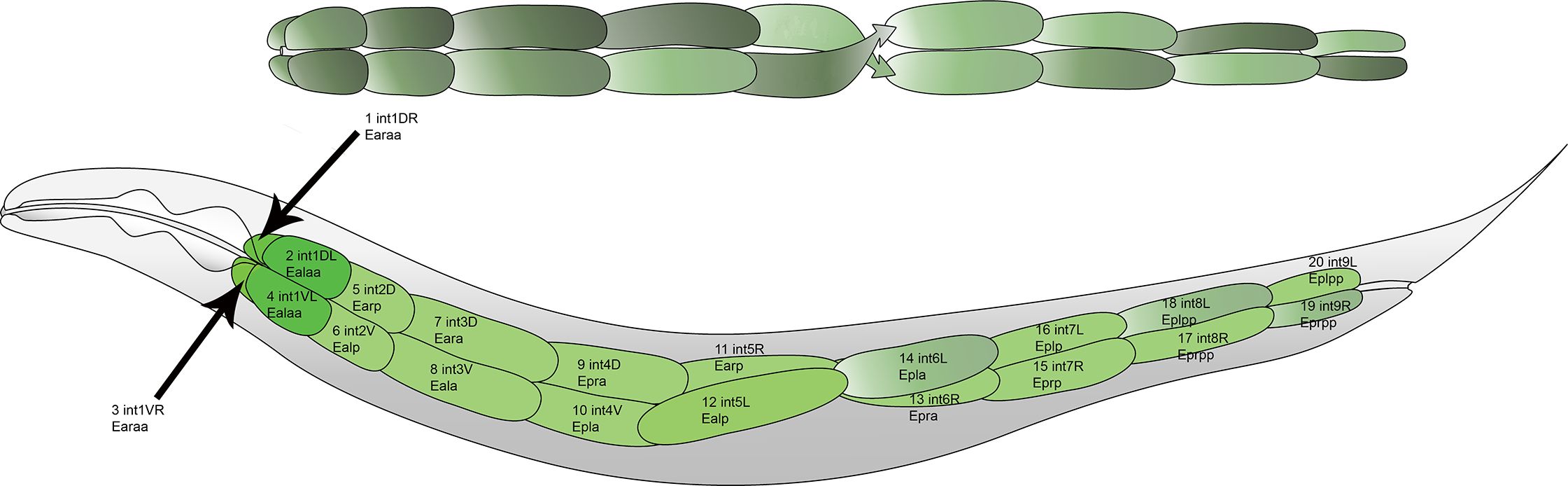
图3 构成成年秀丽隐杆线虫肠道的细胞布局[8]
动物模型——斑马鱼模型
斑马鱼具有良好的可视化效果及类似人类的免疫系统和肠道功能,因此也被广泛应用于研究肠道生态失调。作为微生物研究的经典模型,斑马鱼的肠道微生物群已得到充分表征,并且存在现成的无菌(GF)系。斑马鱼胃肠道系统的高度可控性使得研究人员能够降低动物个体间的差异水平[9]。表观遗传调节功能的丧失会增加肠上皮细胞数量,并产生与慢性炎症一致的症状[10],这一发现意味着,表观遗传调节因子的突变和功能障碍可能导致炎症性肠道疾病(IBD)的特征性症状。尽管斑马鱼的消化系统在功能上是保守的,但值得注意的是,斑马鱼没有胃,而是具有在解剖学上分为独立部分的消化道:口、食管、三个肠段[11](图4)。因此,斑马鱼也是一个具有较高价值的模型,可用于高效的研究肠漏,然后将研究结果应用到哺乳动物模型中。
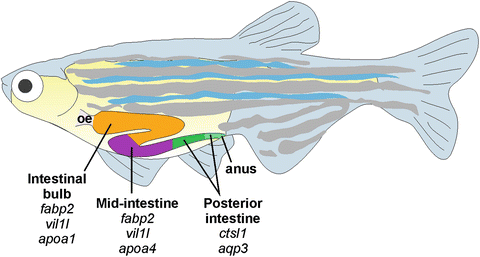
图4 斑马鱼胃的解剖图[12]
总结
在哺乳动物中,肠道上皮细胞之间的紧密连接构成了阻止大分子进入肠道的关键屏障。同样,秀丽隐杆线虫的上皮细胞也含有黏附复合物(图5)。尽管秀丽隐杆线虫与哺乳动物、脊椎动物和果蝇之间存在三个显著差异:线虫细胞-细胞黏附复合物(顶端连接)有一个单一的电子致密区,LET-413与DLG-1不共定位,管状器官膜包括AR-3、PAR-6、PKC-3和CRB-1蛋白。但研究证实,秀丽隐杆线虫上皮细胞遵循与哺乳动物细胞相似的机制,这一发现不仅加深了我们对于肠道上皮屏障在不同生物体中的运作原理的理解,揭示了生物在不同进化阶段对于维持肠道屏障完整性的共同机制,而且证明了秀丽隐杆线虫作为模式生物在研究微生物生态失调、胃肠道炎症和肠道疾病发病机制中的潜在价值[7]。秀丽隐杆线虫在肠道屏障领域的研究发现令人兴奋且具有里程碑意义。秀丽隐杆线虫、斑马鱼等替代动物模型的出现为传统哺乳动物模型提供了快速、经济的补充优势,有望加速该领域的研究突破,并促进资源的有效利用。
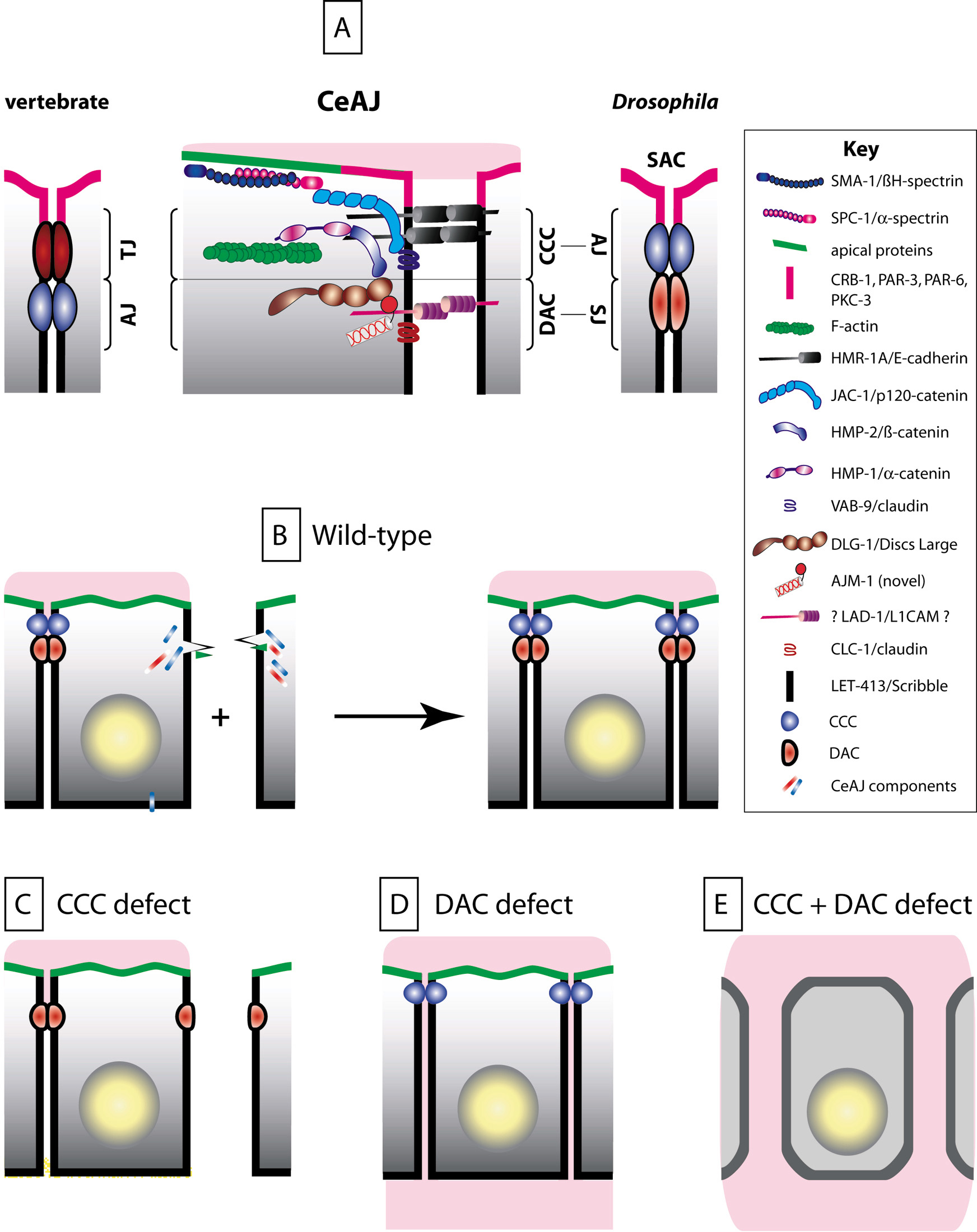
图5 CeAJ和细胞间黏附与脊椎动物的紧密连接具有类似的功能[11]
参考文献
[1] Physiopedia (2022). Gut Brain Axis(GBA), Physiopedia.
[2] Cheng, C.K. & Huang, Y. (2021). The gut-cardiovascular connection: new era for cardiovascular therapy, Medical Review, vol. 1, no. 1, 2021, pp. 23-46
[3] Cleveland Clinic (2022). Leaky Gut Syndrome.
[4] González-González, M., Díaz-Zepeda, C., Eyzaguirre-Velásquez, J., González-Arancibia, C., Bravo, J. A., & Julio-Pieper, M. (2019). Investigating Gut Permeability in Animal Models of Disease. Frontiers in physiology, 9, 1962.
[5] Maduro M. F. (2017). Gut development in C. elegans. Seminars in cell & developmental biology, 66, 3–11.
[6] Kong, S., Zhang, Y. H., & Zhang, W. (2018). Regulation of Intestinal Epithelial Cells Properties and Functions by Amino Acids. BioMed research international, 2018, 2819154.
[7] Kim, M. R., Cho, S. Y., Lee, H. J., Kim, J. Y., Nguyen, U. T. T., Ha, N. M., Choi, K. Y., Cha, K. H., Kim, J. H., Kim, W. K., & Kang, K. (2022). Schisandrin C improves leaky gut conditions in intestinal cell monolayer, organoid, and nematode models by increasing tight junction protein expression. Phytomedicine : international journal of phytotherapy and phytopharmacology, 103, 154209.
[8] Mendenhall, A. R., Tedesco, P. M., Sands, B., Johnson, T. E., & Brent, R. (2015). Single Cell Quantification of Reporter Gene Expression in Live Adult Caenorhabditis elegans Reveals Reproducible Cell-Specific Expression Patterns and Underlying Biological Variation. PloS one, 10(5), e0124289.
[9] Hamilton, M. K., Wall, E. S., Robinson, C. D., Guillemin, K., & Eisen, J. S. (2022). Enteric nervous system modulation of luminal pH modifies the microbial environment to promote intestinal health. PLoS pathogens, 18(2), e1009989.
[10] Marjoram, L., Alvers, A., Deerhake, M. E., Bagwell, J., Mankiewicz, J., Cocchiaro, J. L., Beerman, R. W., Willer, J., Sumigray, K. D., Katsanis, N., Tobin, D. M., Rawls, J. F., Goll, M. G., & Bagnat, M. (2015). Epigenetic control of intestinal barrier function and inflammation in zebrafish. Proceedings of the National Academy of Sciences of the United States of America, 112(9), 2770–2775.
[11] Wallace, K. N., Akhter, S., Smith, E. M., Lorent, K., & Pack, M. (2005). Intestinal growth and differentiation in zebrafish. Mechanisms of development, 122(2), 157–173.
[12] Lobert, Mouradov & Heath (2016). Focusing the Spotlight on the Zebrafish Intestine to Illuminate Mechanisms of Colorectal Cancer, Advances in Experimental Medicine and Biology book series (AEMB,volume 916), Cancer and zebrafish.
[13] Labouesse, M. (2006). Epithelial junctions and attachments, WormBook.
撰稿:张壬辉
审核:陈岚彬
编辑:余雯