点击蓝字 关注我们

微生物对其动物宿主展现出诸多裨益。在肠道中,微生物执行生物合成的功能,为它们的宿主补充无法通过自身代谢合成的物质,从而促进了宿主的营养平衡与健康维持。在上皮屏障中,微生物通过调节宿主免疫和系统抑制炎症来发挥重要的免疫调制的功能。某些共生微生物与宿主神经系统之间存在着复杂的相互作用机制,它们能够生产并传递具有神经活性的代谢物,这些代谢物不仅调节宿主的生理机能,还显著影响宿主的情绪状态与行为模式。鉴于微生物对宿主健康的深远影响,动物宿主天生具备一种能力,即能够感知并优先与那些有益于其健康的微生物建立关联。但目前我们对于动物如何具体感知并识别出这些健康促进型微生物的分子机制与生物学途径知之甚少。
秀丽隐杆线虫摄食环境中的微生物,为其提供能量和全部必要的生物合成功能,例如血红素、胆固醇和代谢辅因子等。在自然界中,线虫所处的生态系统充斥着纷繁复杂的微生物种群,这些微生物构成了支撑线虫生长与健康的重要基石。然而,与此同时,线虫亦面临着来自致病性微生物的潜在威胁,这些微生物可能对线虫的生存造成不利影响。因此,线虫必须发展出一套精细的识别机制,以区分那些促进其生长的营养微生物(nutritive microbe)与可能具有营养匮乏或致病性的微生物。线虫的神经系统在调节与环境微生物互作中发挥着主要作用。线虫依靠与微生物特异性侵染和致病化学信息素之间的联系,识别并且回避致病微生物。这种能力不仅体现在对特定病原微生物的本能回避上,还表现在线虫对有益营养微生物的积极趋向行为上,从而实现了对微生物环境的主动选择与优化。
线虫依赖其学习与本能的微生物偏好性,要求其化学感应神经元能监测到微生物特异性信息素。这一复杂的化学感应神经系统,赋予了线虫识别并响应广泛的化学刺激的能力。目前仅发现少数来自微生物的化学信号引导线虫功能的行为表现,其中主要针对线虫对病原微生物的识别。为了更好地理解动物如何识别微生物,纽约大学医学院Niels Ringstad研究团队聚焦于线虫对营养的大肠杆菌(Escherichia coli,E. c.)和致病的粪肠球菌(Enterococcus faecalis,E. f.)的本能偏好差异的神经基础。同时,他们鉴定了大肠杆菌富集代谢物的化学感应神经元,这是一条对营养大肠杆菌趋化性的关键下游中间神经元,以及发现该神经回路中感应营养细菌产生的多胺代谢物质。现在就由小编和大家一起分享他们的发现之旅。


化学感应可快速区分病原菌和营养微生物

一些营养细菌可吸引线虫在其菌落上驻留,而线虫对致病细菌的厌恶性导致线虫回避和漫无目的地爬行行为。作者在平板的一个区域滴定营养细菌,在另一个区域滴定粪肠球菌,比较饲养良好的雌雄同体线虫对上述两者的行为表现。使用视频跟踪显示,线虫能快速地聚集在营养细菌菌落上,致病性粪肠球菌菌落不能吸引和保留线虫(图1A、B)。线虫在数分钟内产生的行为差异表现暗示线虫对细菌的感知机制独立于侵染过程,从而引发对微生物不同行为反应的分化。为了验证这个推测,作者选用了tax-4和osm-9双突变体线虫(tax-4和osm-9是编码化学感应转导所需的离子通道蛋白),结果显示tax-4;osm-9突变体完全废除线虫对营养细菌的驻留表型(图1A、B)。
为了查明线虫是如何感应营养细菌和致病菌的,作者使用一株在感觉神经元表达高敏感钙指示剂GCaMP6f的转基因线虫品系(Parl-3::GCaMP6f,图1C)。通过微流控设备固定线虫,从线虫头部连续流过包含有营养细菌或致病菌粪肠球菌的培养基,研究者能够实时记录感觉神经元的光学信号变化。在大肠杆菌和粪肠球菌条件性培养基之间,作者观察到强烈的感觉神经信号的差异性。ASE、ASH和ASK神经元对粪肠球菌的响应具有偏好性,暗示这些神经元可以检测致病菌特异性的代谢物(图1D-F)。相比较之下,ADF、ASG、ASI和AWA神经元对大肠杆菌的响应具有偏好性,表明这些神经元可以检测营养细菌的特殊代谢物(图1G-J)。尽管上述神经元表现出对刺激存在的响应,但是AWC神经元却是在移除它们所检测到的气味时才会被激活。由于作者在撤回大肠杆菌培养基时,观察到AWC神经元具有强烈的响应(图1K),因此,将AWC神经元与ADF、ASG、ASI和AWA一起归为对营养细菌的化学信号具有偏好响应的一组。另外AWB对两种细菌的特异性信号刺激均有响应,而ADL和ASJ神经元几乎不或没有对两种细菌转化表现出响应。
文章中确认的微生物响应神经元类型是两侧对称的神经元。在ASE和AWC神经元中,左右两侧神经元功能是不同的,可以对不同的刺激做出响应。但是,作者并没有发现在微生物感应中ASE单侧功能的证据。同时超过70%的AWC两侧神经元对大肠杆菌的刺激具有响应,这明显高于AWC单侧神经元对大肠杆菌检测的期望率。总之,这些数据支持线虫化学感应神经系统可快速识别微生物。
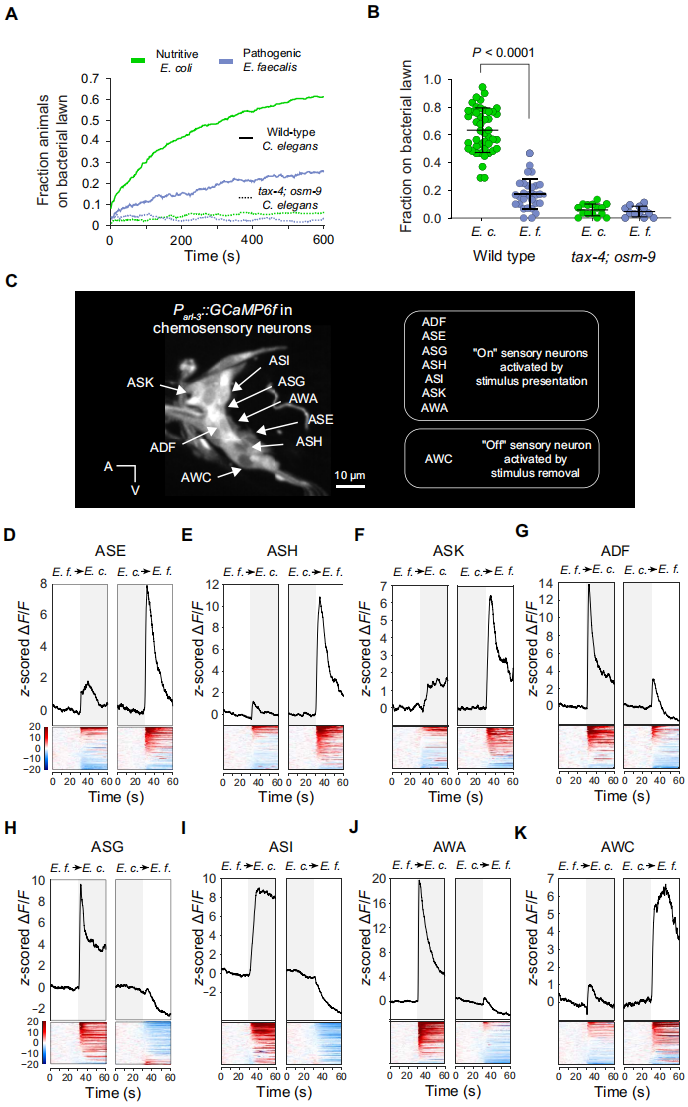
图1 线虫利用化学感应快速识别并对有益微生物作出响应

AIB中间神经元破译对微生物的感知响应,并引导觅食行为

那么,对微生物响应是如何被破译并引导线虫的觅食行为的呢?在线虫的感觉神经系统中,有少数的中间神经元集中收到来自不同感觉神经类型输入的信息。微生物响应化学感应神经元突触在AIB和AIZ中间神经元,AIB神经元在感觉神经和前运动神经之间占据着重要的位置。因为AIB神经元收到感觉神经元的兴奋和抑制信号,所以在文章中作者的微生物条件性培养基试验激活的多个神经元(ASE、ASH、ASK、AWC、ADF、ASG、ASI和AWA)可能激活或抑制AIB神经元(图2A)。为了确定微生物感应神经元激活是如何影响AIB神经元的活性,作者首先使用遗传编码的钙整合器CaMPARI(Podr-2b::CaMPARI,CaMPARI是一种光转换荧光基团,即在无钙离子结合且405 nm激活后呈现出绿色荧光,但结合钙离子且405 nm激活后发出红色荧光。图2B)来测量在线虫自由活动条件下暴露于营养或致病微生物对AIB神经元活性的影响;在急性暴露与大肠杆菌或粪肠球菌期间测量CaMPARI的钙依赖光转换信号。在与空白暴露的对照线虫比较中,AIB神经元在线虫暴露于营养细菌时显著降低CaMPARI光转换信号,这表明对大肠杆菌的感应抑制AIB神经元的活性。相比之下,当动物暴露于致病菌粪肠球菌时对AIB的CaMPARI光转换信号无显著影响(图2C)。
同时,作者观察到AIZ神经元也有与AIB神经元相似的差异效果。为了确定AIB神经元是如何对微生物特异性的信息素起到动态响应的,作者再次使用GCaMP6f在AIB神经元中记录其钙离子信号,与之前的试验相似,作者将线虫固定在微流控设备上,将线虫暴露于含有大肠杆菌或粪肠球菌的培养基中。当线虫暴露于大肠杆菌时,AIB神经元离子信号快速降低,这个结果与上述线虫暴露于大肠杆菌时AIB的CaMPARI光转换试验结果是一致的(图2D)。在线虫感应粪肠球菌中时也可诱导降低AIB神经元钙离子信号,但是抑制AIB神经元对粪肠球菌的响应信号要更低于AIB神经元对大肠杆菌的响应(图2E)。而且,当线虫以先暴露于粪肠球菌后再暴露于大肠杆菌的顺序记录钙离子信号时,AIB神经元展现出巨大的抑制响应(图2F),这表明感知大肠杆菌特异代谢物的感觉神经元信号是传导到AIB中间神经元的,而在tax-4;osm-9突变体背景下,AIB神经元则没有发生响应。这些数据表明,那些检测大肠杆菌特异信息素的一套感觉神经元抑制AIB中间神经元的活性,并且对AIB中间神经元的抑制是线虫对营养微生物发生行为响应是很重要的。
接下来作者测试通过感知营养大肠杆菌而引起的运动行为是否需要AIB神经元。上文中(图1A)我们提到线虫在大肠杆菌菌落上快速累积。首先,作者衡量线虫对两种细菌的化学趋化性,结果显示线虫对大肠杆菌的趋化指数显著高于粪肠球菌(图G-H);其次,衡量在进入菌落后离开菌落的可能性,作者发现线虫几乎不离开营养大肠杆菌,相比之下,线虫离开致病粪肠球菌的频率更高。文章中在AIB神经元中表达组胺门控氯离子通道蛋白(histamine-gated chloride channel,HisCl1,即在组胺存在可以细胞特异性的沉默表达HisCl1的神经元,Pinx-1::HisCl1)化学性的沉默AIB神经元,结果显示线虫离开大肠杆菌菌落的可能性没有影响,但是强烈地降低对大肠杆菌的趋化性(图2I)。这些数据表明化学感应信号输入到AIB中间神经元对于线虫感知营养细菌而产生的迁移行为是必须的,但是对于促进驻留在菌落上的行为存在不同的神经机制。
为了确定AIB神经元在对营养细菌的化学趋化性中的作用,作者采用光遗传学方法,在觅食线虫的AIB神经元中表达视紫红质(Archaerhodopsin,是一种黄色光激活的质子泵,能够将带正电的质子从胞内转移到胞外,使神经元处于超极化状态,保证神经元处于静息状态。Pinx-1::arch),并随机暴露于定时的1秒光脉冲光中,并将未受AIB抑制的线虫轨迹与已受抑制的线虫轨迹进行比较(图2J)。这个试验设计允许对单只线虫中比较抑制和非抑制条件下的线虫行为。作者观察到AIB抑制对线虫运动速度没有显著影响,但是那些在试验中受到AIB抑制的线虫改变它们的行为,在其间它们的运动距离相对于初始位置更短(图2K)。这个结果与之前使用细胞消融和化学抑制AIB神经元的研究结果是一致的,表明AIB神经元在抑制移除后可以调节线虫的再定位。因为来自营养大肠杆菌的化学信号引起AIB神经元的急性抑制,依据这些数据推测,当动物检测到来自大肠杆菌信息素浓度下降时,线虫将改变行为,并表明AIB神经元在趋化机制中发挥传统的作用。AIB神经元可能是线虫计算分析受到的化学刺激是吸引还是厌恶的关键神经元。
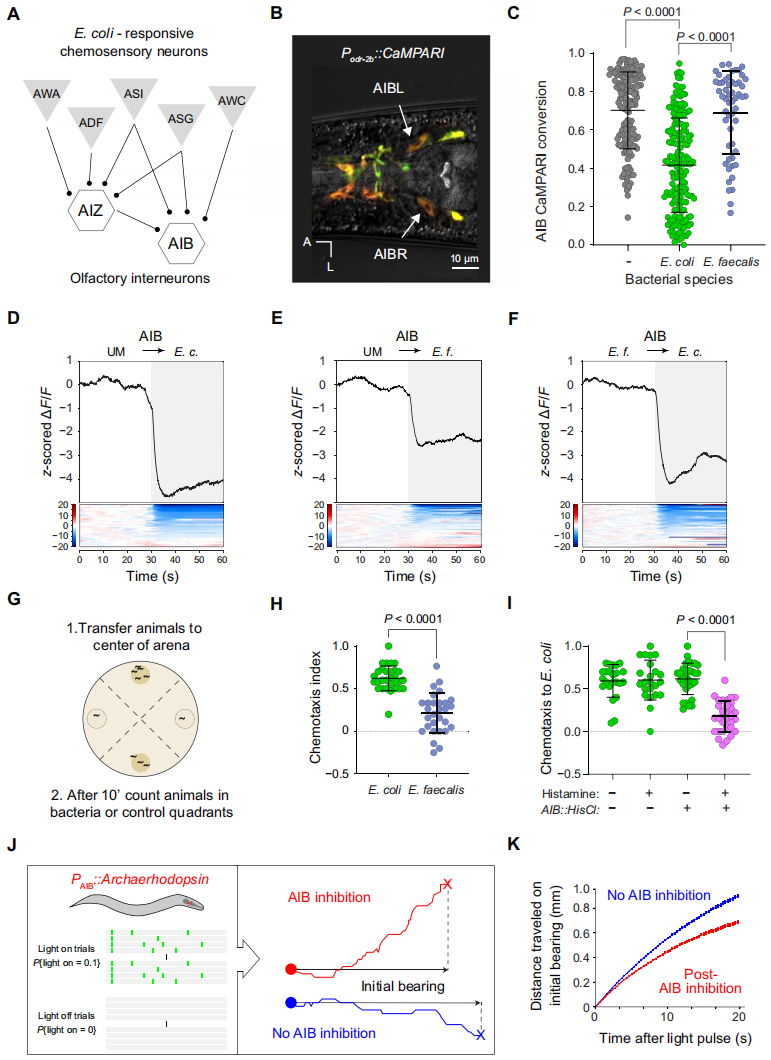
图2 AIB中间神经元整合化学感觉神经元的输入的信息

细菌多胺代谢物激活微生物感应神经元,并引导其趋化性

我们前文介绍过,作者已经鉴定了那些在化学感应神经回路中引导线虫趋向营养大肠杆菌的神经元功能,接下来作者将探寻被神经回路感应的分子信息素。通过使用非靶向的液相层析串联质谱(liquid chromatography–mass spectrometry,LC-MS)绘制大肠杆菌和粪肠球菌培养基中的分子成分图谱。经主成分(Principal component,PC)分析显示包含营养大肠杆菌和致病粪肠球菌的培养基彼此之间具有显著差异的代谢组(图3A)。在比较大肠杆菌和粪肠球菌培养基中鉴定了282种代谢物(在大肠杆菌中至少2倍富集)。其中最丰富的代谢物是乙酰化形式的尸胺(cadaverine),展现出超过7倍的log2富集值。对大肠杆菌富集代谢物进行检查时,显示另外两种乙酰化多胺,N-乙酰腐胺(N-acetylputrescine)和N8-乙酰亚精胺(N8-acetylspermidine)的高富集(图3B-E)。
文章中使用的非靶向代谢组不能可靠地检测到非乙酰化的多胺物质,是由于这些化合物离子化较差。因此为了更进一步确认大肠杆菌培养基中是否同样富集非乙酰化的多胺,作者依靠在微生物培养基进行丹磺酰作用产生衍生代谢物,在含胺化合物中添加大的可电离的构象(图3F)。使用该方法,作者对大肠杆菌和粪肠球菌培养基中丹磺酰化的多胺和丹磺酰化的乙酰多胺进行靶向代谢组分析。与非培养条件的培养基相比,含大肠杆菌培养基高度富集了乙酰化和非乙酰化的多胺,而粪肠球菌培养基中没有富集多胺(图3G)。
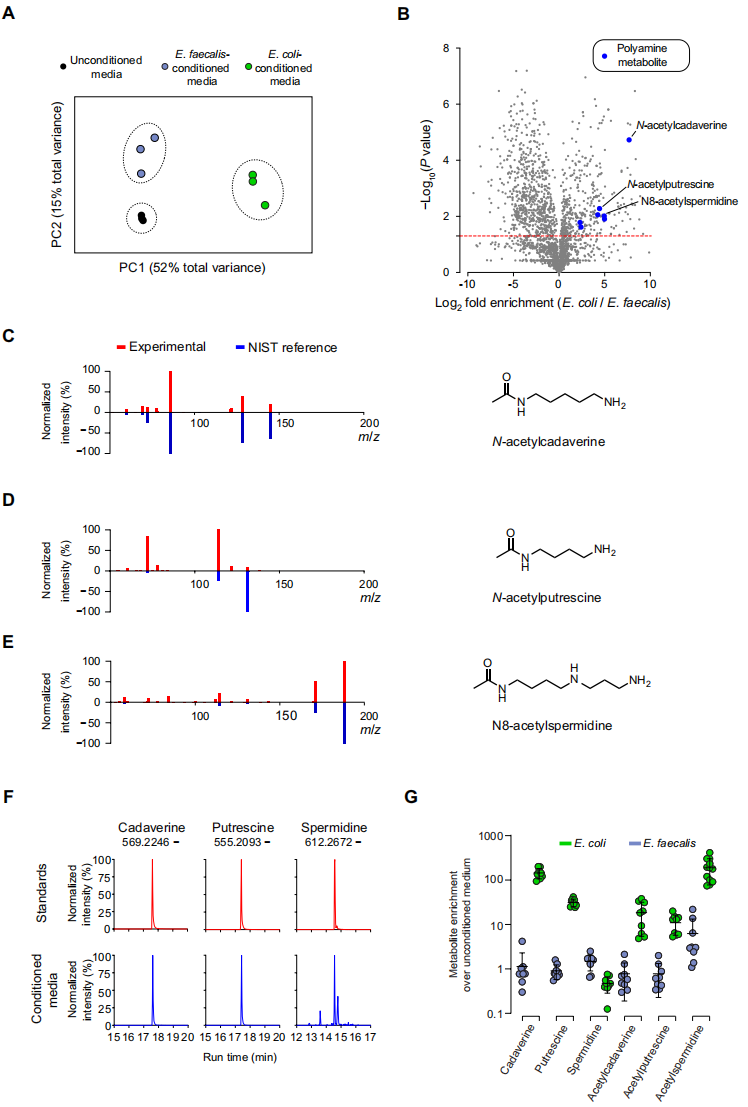
图3 多胺类代谢物是营养大肠杆菌的标志物
文章评估了一系列不同的微生物种,这些微生物能引起线虫不同的行为响应以及它们差异的致病性对AIB活性的作用。使用上述CaMPARI试验,线虫暴露于粘质沙雷菌(Serratia marcescens)和铜绿假单胞菌(Pseudomonas aeruginosa)引起限速的AIB神经元抑制。和大肠杆菌一样,这些细菌能天生地吸引线虫。暴露于金黄色酿脓葡萄球菌(Staphylococcus aureus)不能抑制AIB神经元,与粪肠球菌一样,这些细菌不能吸引线虫(图4A)。于是,作者使用靶向LC-MS分析微生物多胺合成,并衡量尸胺的产量。结果显示这些微生物中尸胺的产量各不相同(图4B),但是尸胺产量最高的微生物对线虫具有本能的吸引能力。这些数据表明多胺类物质,例如尸胺等可能被线虫感应并控制其对微生物的响应行为。
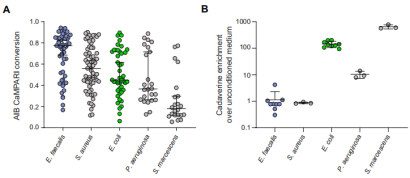
图4 在多种微生物中AIB抑制和多胺类富集度呈现相关性
为了确定多胺代谢物是否可以被线虫感知并作为指引线虫找到营养微生物的指示剂,作者将细菌中富集的多胺类物质,尸胺、腐胺、亚精胺和少量精胺混合用于刺激化学感觉神经元的活性。在五个神经元中,有两个神经元对多胺类物质产生响应,ADF神经元在多胺类存在下产生响应,而AWC神经元在移除多胺刺激时产生响应,这与大肠杆菌培养基的响应是一样的(图5A-E)。上文中,我们提到尸胺是在大肠杆菌培养基中富集度最高的多胺类物质,于是作者单独测试尸胺是否能有效地激活ADF和AWC神经元。结果显示尸胺可有效地激活ADF和AWC神经元,并且呈现出浓度依赖效应。其中AWC神经元对尸胺的敏感性极强,达到飞摩尔浓度级,而ADF神经元则在纳摩尔浓度级(图5F-G)。因此,文章认为多胺类代谢物,尤其是尸胺,可被线虫五个感觉神经元中的两个感知,并与检测到营养微生物相关联。
既然多胺类代谢能引起ADF和AWC神经元响应,那么它们能否引起AIB中间神经元产生响应呢?CaMPARI试验结果显示多胺类混合物能导致快速抑制AIB中间神经元(图5H)。同时,化学趋化试验表明尸胺能引起线虫本能的吸引作用,但是在化学沉默AIB中间神经元(Pinx-1::HisCl1)后则废除线虫对尸胺的趋化性(图5I)。线虫对粪肠球菌没有表现出趋化性,但是如果在粪肠球菌培养基中添加多胺类混合物,发现能显著提高线虫对粪肠球菌的趋化性。
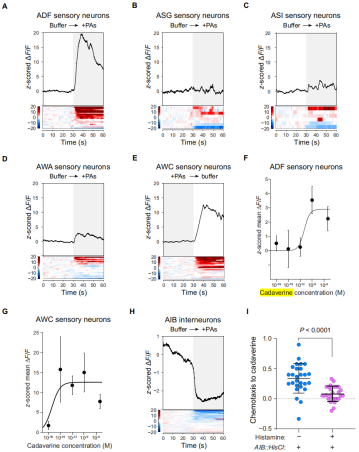
图5 多胺类代谢物被线虫神经元所感知,并引导其产生趋化性
多胺类物质在多大程度上决定线虫对大肠杆菌的吸引力呢?为了回答这个问题,作者使用一株导致大肠杆菌合成多胺物质缺陷的突变基因的菌株,作者使用靶向代谢组衡量内源多胺含量,结果显示在基本培养基上该突变体缺乏多胺类物质合成(图6A)。在比较野生型和多胺缺陷型大肠杆菌对线虫趋化性的影响时,作者发现多胺缺陷型显著降低对线虫的趋化性(图6B)。线虫的正趋化指数表明多胺缺陷大肠杆菌仍然能合成一些吸引线虫的信息素。上述数据进一步显示内源性多胺类物质大肠杆菌代谢物中的关键成分,它们被线虫探测到并引导线虫向营养大肠杆菌反向行进(图6C)。
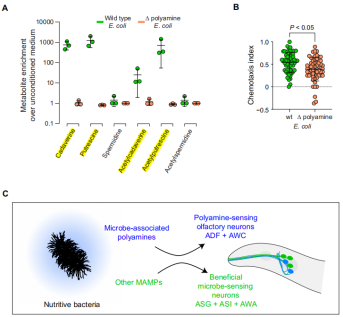
图6 多胺合成途径缺失减少线虫对营养细菌的吸引力

总结

多胺类物质是已知的作为与行为学的相关的气味分子,可诱导动物产生本能行为。暴露于尸胺、腐胺和亚精胺的小鼠会引起焦虑和回避行为。相似地,斑马鱼将尸胺和腐胺作为高度厌恶的气味分子。其他动物,例如线虫,被这些多胺类物质吸引。大鼠、金鱼和果蝇感应尸胺和腐胺作为食欲信息素。文章讨论介绍,脊椎动物感应多胺类物质使用痕量胺相关受体(trace amine-associated receptors,TAARs),它是脊椎动物特异性的G蛋白偶联受体的进化分支,其是由代谢型儿茶酚胺和单胺受体演化而来的。但是线虫基因组中缺乏TAARs或昆虫气味受体,这表明蠕虫中拥有其自身的机制可通过嗅觉检测多胺类物质,其中相关的受体内容可进一步挖掘。如果秀丽线虫对多胺类的趋化行为在蠕虫类中保守的话,那么多胺类,尤其是尸胺,是否可以开发出诱捕线虫并用于杀线虫的农药使用呢?文章中也介绍了部分研究线虫神经元的部分方法,例如CaMPARI光转换钙信号、GCaMP6f钙信号、Archaerhodopsin光抑制神经元、HisCl1化学抑制神经元以及趋化试验等,感兴趣的读者可以阅读原文进一步了解。

参考文献
Brissette B, Ficaro L, Li C, Jones DR, Ramanathan S, Ringstad N. Chemosensory detection of polyamine metabolites guides C. elegans to nutritive microbes. Sci Adv. 2024;10(12):eadj4387. doi:10.1126/sciadv.adj4387
撰稿:卞文印
审核:陈岚彬
编辑:余雯