
点击蓝字

关注我们
引言


微流控技术是一种在微尺度上操控液体的技术,也被称为“芯片实验室”,其核心在于将复杂的生物化学实验过程集成到一个微小的芯片上。这种技术在生物学研究中得到了广泛应用。秀丽线虫因其简单的生物结构、短生命周期和高度的基因保守性,成为研究生物学和医学问题的重要模式生物。微流控技术的出现为线虫研究提供了新的平台,其微型化和高通量的特点使得在微尺度环境中对线虫进行精确操控和研究成为可能。
行为学研究


微流控技术为研究线虫的行为反应提供了新的途径。通过在微流控芯片中模拟不同的环境条件,如化学梯度或温度变化,研究人员能够观察线虫的运动行为和趋化反应。如下图所示,一种新型微流控装置,能够自动刺激线虫头部和尾部的神经元,帮助研究人员观察线虫在不同气味刺激下的行为变化,从而揭示其嗅觉神经回路的功能[1]。另一种微流控装置为“头部摆动芯片”,这种芯片允许线虫自由移动头部,而身体其余部分固定在原位。通过Y形入口设计,线虫可以感知不同的NaCl浓度,研究者能据此分析其行为与环境NaCl浓度的关系。这种设计有助于研究线虫对化学梯度的感知和趋化反应[2]。

图1 用于行为研究的微流控装置
神经领域


微流控芯片实现了对线虫的精确刺激和实时成像,为研究其神经反应提供了可能。神经元成像芯片采用多层设计,如双层结构,上层为阀门层,下层为流层,这样能实现对线虫的精准操控和刺激传递。芯片内部包含多个微通道和陷阱结构,用于引导和固定线虫。配备的高分辨率显微镜及相机能够对线虫的神经元进行清晰成像(图2)。得益于秀丽线虫的透明特性,在实验过程中可以利用荧光成像技术观察其神经元的活动。研究人员可以使用遗传编码的钙指示剂(如GCaMP家族)标记神经元,通过荧光显微镜观察钙离子浓度的变化,从而实时监测神经活动[3]。总之,基于微流控技术的秀丽线虫神经元成像平台具有高通量、高分辨率、精确控制等优势,能够为神经科学研究提供强有力的支持和新的研究思路。
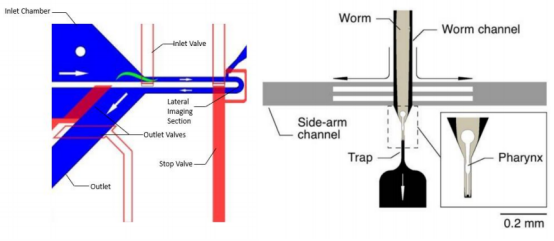
图2 用于神经生物学的微流体装置
高通量衰老领域


利用传统方法研究线虫的衰老机理存在若干挑战,例如在琼脂平板上培养时,难以监测个体反应和识别群体内异质性。手动将线虫固定在琼脂垫上进行成像,过程复杂且效率低下。微流控平台的出现在很大程度上解决了这些问题,它能够实现线虫的长期培养和精确操控,是研究衰老和发育的理想工具。WormFarm微流控系统可以自动化地培养线虫,并动态观察其衰老过程。这种系统能够提供稳定的微环境,保证实验的连续性和数据的准确性。基于微流控技术开发的高通量衰老模型平台由两个相互连接的主要部分组成,一部分用于过滤后代同时保持亲本种群完整,另一部分用于将线隔离在单独的微环境中进行显微镜观察。该设备通过降低温度来固定线虫,并且能够在一个无药物的环境中,维持约1000条线虫的种群在其整个生命周期内保持年龄同步,并进行一系列高分辨率显微镜研究(图3)。通过高通量筛选,研究人员可以快速识别影响线虫寿命和发育的生物标志物,包括基因表达的变化、蛋白质和RNA的质量控制系统的改变等[5-6]。因此,微流控技术可以高效地筛选和评估多种抗衰老化合物,为开发新的抗衰老干预措施提供了基础。

图3 用于高通量衰老模型的微流控芯片
药物筛选


微流控技术在药物筛选中的应用尤为突出,基于该技术的药物筛选系统可以实现数千个反应的同时测试和分析,大大提高了实验规模和效率。在筛选过程中,通常需要固定秀丽线虫以便进行观察和检测。传统的固定方法如使用胶水或麻醉剂可能会对细胞产生不利影响。而微流控技术则提供了一种无创伤、高通量的固定方法,如利用内置阀门的聚二甲基硅氧烷(PDMS)微流控芯片来控制线虫的悬浮和固定。这种方法不仅避免了传统固定方法的弊端,还提高了固定的效率和准确性。通过自动化系统,研究人员可以快速测试不同药物对线虫生理和行为的影响,筛选效率高且实验成本低[7]。
Daphne Bazopoulou等人开发了一个与多孔板兼容的自动化钙成像平台,该平台包括多孔板到生物芯片接口模块和微流控耦合功能成像模块。平台通过三个计算机控制的阀门实现线虫的转移、加载、卸载以及刺激的传递(图4)。他们筛选了一个包含107种FDA批准药物的定制库,以识别能够改善老年线虫神经元活动的药物。最终发现抗癫痫药物Tiagabine能够改善老年线虫的神经元活动,使ASH神经元活动增加2倍。由此可见,秀丽线虫作为药物筛选的生物模型具有独特优势,而微流控技术则为其提供了更加高效、准确和可靠的筛选平台[8]。
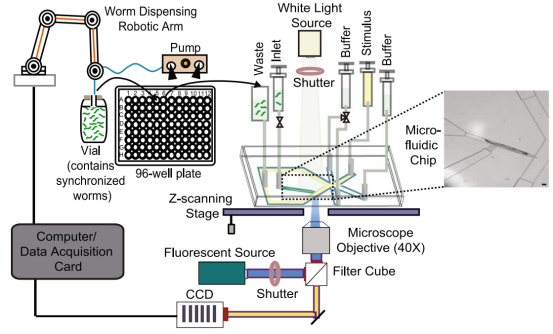
图4 用于药物筛选的微流控平台
总结


微流控技术在秀丽线虫研究中的应用极大地推动了生命科学的发展。其在神经生物学、行为学、衰老及发育研究和药物筛选等方面的应用,为揭示生命过程中的复杂机制提供了新的工具和方法。展望未来,随着微流控技术的不断进步,其在秀丽隐杆线虫研究中的应用将更加广泛和深入,有望为人类健康和疾病治疗提供更多的科学依据。
参考文献:
1. Karimi S, Gat A, Agazzi C, Oren-Suissa M, Krieg M. Automated dual olfactory device for studying head/tail chemosensation in Caenorhabditis elegans. APL Bioeng. 2024 Apr 18;8(2):026104.
2. Matsumoto A, Toyoshima Y, Zhang C, et al. Neuronal sensorimotor integration guiding salt concentration navigation in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 2024 Jan 30;121(5):e2310735121.
3. Midkiff D, San-Miguel A. Microfluidic Technologies for High Throughput Screening Through Sorting and On-Chip Culture of C. elegans. Molecules. 2019 Nov 25;24(23):4292.
4. Wen H, Gao X, Qin J. Probing the anti-aging role of polydatin in Caenorhabditis elegans on a chip. Integr Biol (Camb). 2014 Jan;6(1):35-43.
5. Yarmey VR, San-Miguel A. Biomarkers for aging in Caenorhabditis elegans high throughput screening. Biochem Soc Trans. 2024 Jun 26;52(3):1405-1418.
6. Saberi-Bosari S, Huayta J, San-Miguel A. A microfluidic platform for lifelong high-resolution and high throughput imaging of subtle aging phenotypes in C. elegans. Lab Chip. 2018 Oct 9;18(20):3090-3100.
7. Muthaiyan Shanmugam M, Subhra Santra T. Microfluidic Devices in Advanced Caenorhabditis elegans Research. Molecules. 2016 Aug 2;21(8):1006.
8. Bazopoulou D, Chaudhury AR, Pantazis A, et al. An automated compound screening for anti-aging effects on the function of C. elegans sensory neurons. Sci Rep. 2017 Aug 24;7(1):9403.
撰稿:徐林婷
审核:陈岚彬
编辑:余雯

