
一、阿尔茨海默症简介
阿尔茨海默病(AD)是在1906年首次由德国精神病学家和神经发病学家Alzheimer Alois发现、并以他本人的名字命名的老年痴呆,是一种慢性神经退行性疾病。AD的主要临床表现为记忆力逐渐减退、认知功能发生障碍、行为异常和社交障碍等。
阿尔兹海默症10大早期征兆
全球目前有接近5000万AD患者,而随着世界人口的老龄化问题加剧,据估计AD患者的数目在2060年将会翻三倍,达到1.4亿。目前FDA批准的5种AD治疗药物均属于对症治疗药物,影响疾病进程的药物仍处于初步研究阶段。在阿兹海默病药物研发的历史上充满了各种各样的失败和挫折,AD仍然在困扰日渐增多的老年人群,而治愈这一复杂疾病的“神奇子弹”似乎还未被发现。
已有的研究表明,AD患者的主要病理学特征是β-淀粉样蛋白(A β)聚集成老年斑,细胞内Tau蛋白异常聚集形成神经元纤维缠结(NFT)和神经元死亡。因此,科学家们提出淀粉样蛋白假说(A β假说)与Tau假说,并利用相关老鼠和线虫模型进行药物筛选与有效性验证。
二、秀丽隐杆线虫及其AD疾病模型介绍
自从20世纪60年代遗传学家Sydney Brenner将秀丽隐杆线虫(Caenorhabditis elegans)引入实验室以来,由于它生活史短、繁殖率高、饲养方便、容易保存、细胞数目少以及可在显微镜下追踪每一个细胞的命运,线虫已成为遗传学和发育生物学研究的重要模式生物。最重要的是线虫是多细胞动物,其生长不易受环境影响,可以进行体内实验研究,实验数据稳定可靠。

Sydner Brenner( 1927-2019)
(一)秀丽隐杆线虫作为神经退行性疾病模型的优势
线虫神经系统只有302个神经细胞(约占体细胞的1/3),线虫神经元的结构简单, 只有一个或两个不分叉的突起, 形成或接受突触连结, 但其基本功能与其他动物相似,并具有和其他动物类似的神经递质如乙酞胆碱、五经色胺、多巴胺、谷氨酞胺等。
利用生物信息学方法确定了在近2万个基因中有60%-80%基因与人类是保守的, 人们所了解的17个信号转导通路中有12个在秀丽隐杆线虫中是保守的。目前,越来越多的研究结果中证实了秀丽线虫与人在多种生命活动调控机制上的相似性,因此用线虫作为人类疾病研究和药物筛选的模型具有不可比拟的优越性。
(二)已有AD线虫模型
在研究线虫的过程中,研究人员发现线虫中含有人类APP(A β产生的源蛋白)类似基因apl一1,它在线虫中是跨膜蛋白,但是它不含A β序列,因此需要通过转基因的方式来得到AD模型。1995年,Link CD通过转基因的方式建立了线虫的Aβ模型,转基因线虫模型可用来研究AD毒性机理 、A β引起的基因表达的变化及探究药物抗AD的功效。
在众多实验室研究中,常用的转基因线虫品系主要为CL2006、CL2355、GMC101等。CL 2006线虫使A β在肌肉组织中表达,使线虫表型上出现麻痹瘫痪的症状,复制了AD症状和病理变化。GMC101线虫株不同的是对A β的密码子进行了优化,表达的是毒性强的A β1-42(有研究表明CL2006、CL2355表达的是A β3-42,毒性不如A β1-42),同时引入了绿色荧光蛋白的表型marker。目前在神经元广泛表达A β的线虫用得比较多的线虫为CL2355,不会出现麻痹的表型,但是A β的毒性会影响该线虫株的学习记忆行为,与AD症状更为相似。
三、上源生科的新线虫模型及其优势
(一)新线虫模型的特性
我们实验室正在构建神经元表达的A β线虫株,与CL2355不同的是A β为毒性强的A β1-42而不是A β3-42。最重要的是我们在A β的后面融合了绿色荧光蛋白,这在之前所有的线虫模型都是没有的。荧光蛋白可以帮助我们确定A β的表达量还可定位A β在线虫中的分布,有助于找到A β发挥毒性的致病机理。
另外,我们实验室还在构建在神经元同时表达A β+tau的线虫模型,可用于研究A β与tau对神经元的双重毒性作用与两者在神经细胞内的相互作用关系。目前世界上只有一株同时表达A β+tau的模型,但是他们的表达位置不一样,不能起到双重毒性作用,也没办法研究二者之间的相互作用关系。
(二)利用线虫模型进行AD药物筛选
我们实验室已使用CL2006和GMC101线虫株进行阳性药物的重复实验,试验结果表明阳性药物Quercetin可以很好的减缓A β线虫的麻痹(paralysis)发生率,具体结果如下图:
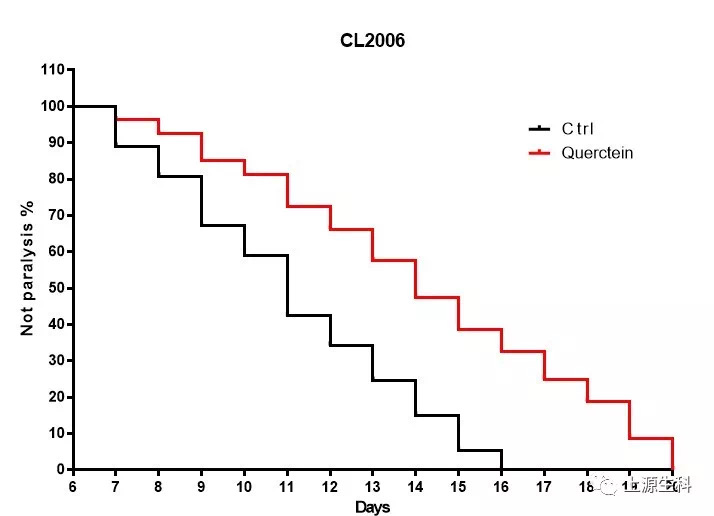
CL2006阳性药物(Quercetin)数据
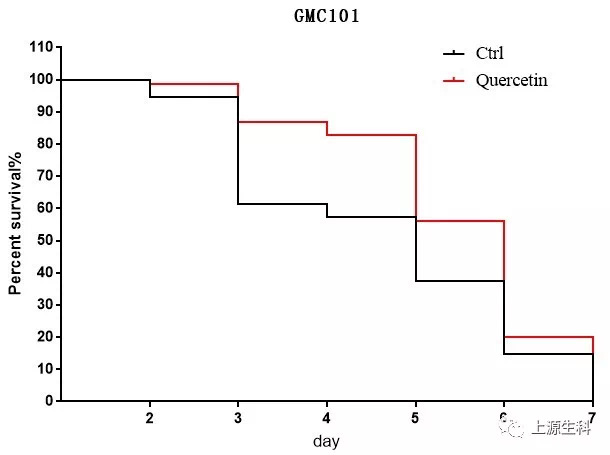
GMC101阳性药物(Quercetin)数据
我们实验室还可对已筛选到的有效果的药进行后续分子机制的研究,找到药物起作用的靶分子和靶信号通路,对后续临床实验设计提供依据。我们还可利用实验室高效的CRIPR/Cas9基因编辑技术对相关基因进行编辑,研究相关基因和其所在通路在AD过程中的作用。
上源生科欢迎有兴趣进行秀丽线虫AD模型构建合作的单位,以及运用线虫AD疾病模型进行药物筛选的制药、医疗机构与我们联系,让我们共同携手攻克难题,造福人类。
联系人:Lancy
邮箱:service@sunybiotech.com

