
点击蓝字 关注我们

大量的研究表明,衰老是由高度保守的基因和信号路径调节的,同时还涉及与环境因子相互作用的分子机制等。除了遗传因素之外,环境改变也能对衰老产生显著的影响。饮食限制(dietary restriction,DR)通常是在保证营养充足的情况下减少食物摄取,是最有利的环境干预方式之一。这种干预方式不仅延长寿命,同时还提高健康活力。科学家们最初发现饮食限制可以延长寿命,是通过减少小鼠的食物摄取后观察到的。随后,其他模式生物如酿酒酵母、秀丽线虫、果蝇和猕猴等也充分证明了饮食限制可延长寿命。虽然目前没有直接的证据将饮食限制与人类寿命联系起来,但许多研究显示饮食限制对人的健康能够产生诸多有益影响。因此,通过利用模式动物为研究对象调查饮食限制的分子机制,并寻找普遍存在的下游靶点,我们可以对这些靶点使用药物进行干预并最终达到延缓衰老的目的。这种研究方法将为我们提供更多关于衰老机制的知识,并为开发新的抗衰老药物提供重要的理论基础。
来自南京大学医学院的陈迪教授团队在Nature Communications杂志上发表了题为“ACS-20/FATP4 mediates the anti-ageing effect of dietary restriction in C. elegans”的文章,揭示了饮食限制诱导寿命和健康寿命延长的关键介质——ACS-20,同时分析了下游转录调控机制。

1
ACS-20是饮食限制诱导的寿命和
健康寿命延长的关键调节因子
在饮食中,脂质代谢对衰老和健康起着重要的作用,然而,脂质代谢网络中特殊的催化酶是否是饮食限制介导的抗衰老作用所必需的?对此,作者对线虫中21个乙酰CoA合成酶(acs)家族基因进行RNAi遗传筛选。乙酰CoA合成酶家族基因通过催化脂肪酸乙酰CoA的合成,启动脂肪酸代谢的初始阶段,脂肪酸乙酰CoA作为一种重要的代谢中间产物进入下游的脂质代谢过程,例如脂质合成降解、蛋白质的脂质修饰以及转录调节因子和信号分子生成等。作者筛选得到acs-20基因,结果显示acs-20(RNAi)能显著抑制饮食限制产生的延长寿命的效果。acs-20突变体在不同的食物稀释浓度下,其平均寿命没有显著变化,并且能够抑制eat-2突变体(饮食限制模型的线虫模型)延长寿命的效果、热胁迫下的抗逆性,以及在抵抗eat-2突变体减少polyQ(亨廷顿疾病线虫模型)蛋白毒性聚集的能力(如图1)。

图1 ACS-20对饮食限制下延长寿命是必须的
作者使用基因编辑技术原位敲入绿色荧光蛋白,发现ACS-20蛋白水平在低营养条件下显著提升,进一步证明ACS-20蛋白水平是受到外界营养条件的调节。
2
ACS-20在饮食限制诱导长寿中具有时空特性
在先前的讨论中,我们提及了作者成功构建的一株acs-20原位敲入绿色荧光蛋白品系。通过观察该品系,作者发现ACS-20主要在表皮和肌肉中表达,并且在成虫阶段后(adult)其表达水平显著降低(如图2)。这说明acs-20的表达模式具有时空特性。

图2 ACS-20表达的时空模式
鉴于ACS-20表达具有时空特性,作者希望深入探究ACS-20在何时(哪个发育时间)以及何处(哪个组织)发挥其由饮食限制诱导的长寿作用。作者采用了全寿命阶段和成虫阶段RNAi、表皮和肌肉的组织特异性RNAi。其结果显示,全寿命RNAi和表皮组织特异RNAi能够完全废除acs-20在饮食限制中诱导的长寿作用。在进一步通过表皮组织特异性挽救acs-20突变体的试验中,作者能够完全恢复饮食限制所诱导的长寿作用(如图3)。
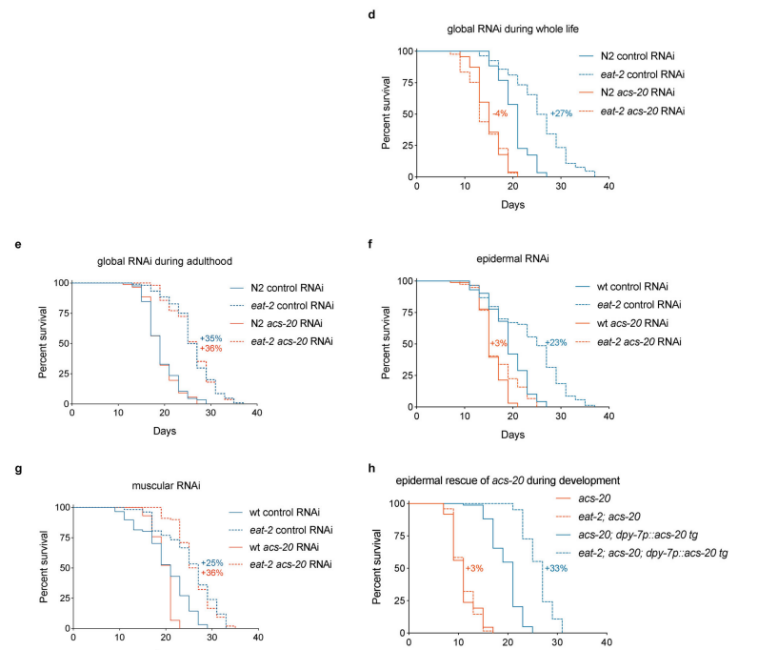
图3 ACS-20的时空模式调节饮食限制的长寿表型
3
ACS-20在脂质代谢中的效果
ACS-20作为乙酰CoA合成酶而非脂肪酸转运体,其人源和小鼠中的同源蛋白FATP4缺陷会引起皮肤脂质代谢缺陷。作者使用油红O染色定量acs-20突变体肠道中的中性脂质水平,结果显示acs-20缺失并未能影响肠道中的脂质水平,而eat-2; acs-20双突变体能轻微增加脂质积累。前文提到ACS-20主要在表皮中发挥功能,作者进一步调查了表皮中脂质成分变化对寿命的影响。由于油红O染色不能定量评估表皮中的脂滴,作者使用表皮特异性的启动子col-12表达DGAT-2::GFP(DGAT-2是一种脂滴膜蛋白)报告蛋白,再通过定量绿色荧光密度反映出脂质水平变化(如图4)。结果表明,acs-20突变体并没有影响表皮脂滴水平变化。综上所述,可以推测ACS-20可能并非通过影响代谢组织中脂质积累来调节饮食限制诱导的寿命延长。

图4 ACS-20对脂质单鞋的影响
4
acs-20突变体的功能转录组分析
为了深入探究ACS-20在衰老作用中的机制,作者对两组线虫(acs-20 vs. N2和eat-2; acs-20 vs.eat-2)的mRNA转录谱进行了详细的比较研究。结果显示两组线虫的mRNA转录谱均有部分基因上调和下调(如图5)。进一步分析发现,在acs-20 vs. N2中不改变表达的基因与eat-2; acs-20 vs. eat-2中上调表达的基因存在95个基因交集(韦恩图),而这些基因则很可能涉及饮食限制特异性的反应。对这95个基因进行GO富集分析(Gene Ontology analysis)显示,这些基因显著集中于内质网非折叠蛋白反馈(ERUPR)。为了验证这些转录组的结果,作者分别使用RT-qPCR试验(abu基因编码内膜蛋白,会随着IRE-1–XBP-1 ERUPR诱导提高表达)和衣霉素处理诱导的内质网应激反馈(hsp-4::GFP作为报告蛋白)。结果均显示acs-20突变体可能损害了蛋白稳态,从而增加了内质网应激的敏感性,并最终造成在饮食限制条件下寿命和健康缺陷的表型。
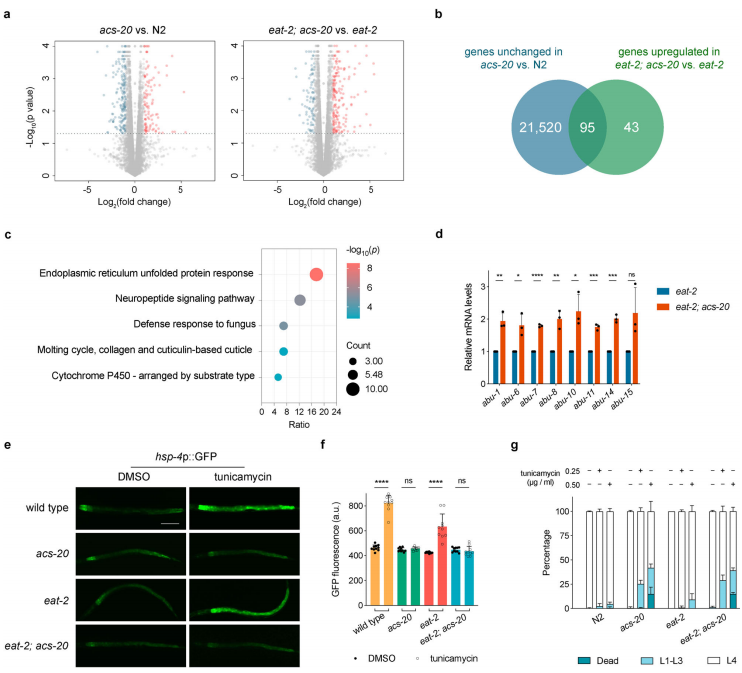
图5 ACS-20功能转录组分析以及对内质网应激的影响
5
PTR-8/Patched作为acs-20关键的
中介物,在饮食限制条件下发挥长
寿和蛋白稳态调节作用
上文中我们提到95个基因交集的韦恩图(图5b),作者在eat-2; acs-20双突变背景下逐一敲降这95个基因,并且发现ptr-8(RNAi)能显著延长eat-2; acs-20双变体寿命。使用基因编辑技术构建ptr-8敲除(lof)突变体线虫品系后,作者发现在ptr-8 (lof)情况下,可显著恢复acs-20突变体和eat-2; acs-20双突变体寿命表型。在eat-2; acs-20双突变背景中ptr-8表达量显著提升,然而在acs-20突变体中则没有显著变化。此外,通过RT-qPCR验证ER应激相关的abu基因表达量、衣霉素敏感的生长发育缺陷试验以及polyQ模型中毒性蛋白聚集,作者发现ptr-8 (lof)压制acs-20 (lof)在饮食限制条件下的表型(如图6)。综上所述,PTR-8在acs-20下游发挥关键调节功能,在饮食限制下调节蛋白稳态和长寿表型。

图6 评价PTR-8对饮食限制在寿命和蛋白稳态的影响
6
NHR-23/RORA位于acs-20下游
并压制ptr-8转录
由于ptr-8转录水平在eat-2; acs-20背景下显著提高,作者构建了一株包含3 kb的ptr-8 5’UTR区的启动子序列驱动绿色荧光蛋白表达的转基因品系(ptr-8 p (3k)::GFP),观察到该品系线虫的GFP荧光主要集中在表皮细胞,并且在eat-2; acs-20双突变背景中,荧光强度显著增强。由此,作者猜测ptr-8转录可能包含在野生型中被压制或者在双突变体中被激活两种可能。为了验证这猜测,作者使用转录因子RNAi子文库(transcription factor RNAi sub-library)在野生型和双体变体中观察对转基因线虫荧光变化。虽然在双突变体中没有找到任何对转基因有影响的转录因子,但是在野生型中作者发现NHR-23 (RNAi)能显著提升GFP表达,并且随后通过ptr-8的RT-qPCR试验也验证了这一点。与acs-20相似,在表皮组织特异性RNAi敲降nhr-23一样压制由饮食限制诱导的长寿表型。
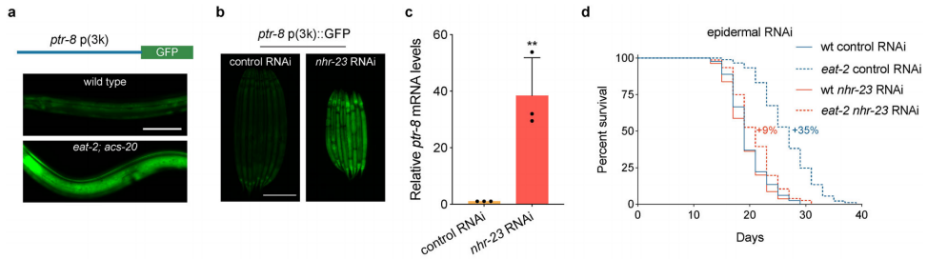
图7 ptr-8 p (3k)::GFP转基因表达模式及评价nhr-23在表皮中敲降对饮食限制诱导的寿命影响
为了进一步验证NHR-23对ptr-8的转录调节,作者在3 kp启动子序列基础上又构建了一系列确定序列缺失(Δ1.5-3 k、Δ2.7-3 k、Δ1.5-1.8 k)的GFP报告蛋白。如果这些缺失区域包含NHR-23作用于ptr-8的顺式作用元件,那么在nhr-23 (RNAi)作用下则不能增强报告基因表达。结果也印证了作者的推测,Δ1.5-3 k区域压制了报告基因表达,而顺式作用元件的更精确范围被确定在Δ1.9-2.7 k之间。

图8 一系列缺失的ptr-8 p::GFP报告蛋白表达情况
为了验证报告蛋白表达的结果,作者使用基因编辑技术在ptr-8基因原位5’UTR区域敲除Δ1.9-2.7 k序列。经过实验比对发现,在野生型中nhr-23 (RNAi)和acs-20 (RNAi)均显著增强ptr-8转录,但在ptr-8 (Δ1.9-2.7 k)线虫中没有明显变化;此外作者还使用anti-GFP的ChIP-qPCR试验确认了在acs-20 (lof)情况下NHR-23降低了对ptr-8 5’UTR区域的结合。ptr-8 (Δ1.9-2.7 k)压制了在饮食限制条件下分别敲降nhr-23和acs-20寿命缩短的表型。

图9 验证ptr-8 (Δ1.9-2.7 k)压制acs-20和ptr-8表型
总而言之,NHR-23作为acs-20的通路的下游,压制ptr-8的表达,并确保饮食限制具有的延长寿命的作用。
总结

饮食限制已被证明是延长寿命的一种有效的环境干预方式,并在多个物种中得到了证实。本研究中,作者从一个新的角度出发,探讨了代谢酶是否在饮食限制中起到关键作用,又将研究集中在脂质代谢酶,从脂质代谢的反应的发起步骤乙酰CoA合成酶家族基因acs,由acs-20到ptr-8,再揭示自acs-20至nhr-23再到ptr-8,进一步探索其核心的调控因子。虽然作者从脂质代谢角度出发,但是acs-20对脂肪酸代谢的影响很小,但是对部分磷脂和鞘脂具有作用,其中的代谢因素还有待进一步研究。acs-20在饮食限制条件下与nhr-23转录因子联系的机制也有待深入讨论。acs-20和ptr-8均在表皮中发挥功能,通过特定的组织影响到个体全局的寿命,作者认为其中是否蕴含细胞非自主的信号路径呢?总体来说,该项研究做了大量的探索工作,仅RNAi一项就至少包含有21 acs家族基因+95交集基因+转录因子子文库,此外还有CRISPR/Cas9基因编辑,单拷贝互补、转基因整合、寿命试验、mRNA-seq、RT-qPCR、ChIP-qPCR、ployQ毒性蛋白验证、衣霉素诱导的内质网应激、Western blot、油红O染色、GC-MS、UPLC/QTRAP-MS等等。该项研究值得认真学习,它将为我们今后在线虫学习研究以及寿命相关探索工作中进一步拓展思路。
撰文:卞文印
审校:陈岚彬
编辑:余雯