

点击蓝字 关注我们

荧光原位杂交(Fluorescence in situ hybridization,FISH)是一种在细胞或组织水平上检测和定位特定DNA序列的分子生物学技术。该技术通过将荧光标记的核酸探针与目标DNA杂交,从而实现对特定基因或染色体结构的研究。秀丽隐杆线虫肠道内居住着多种微生物,包括肠道微生物群、细菌和病原体,如微孢子虫和病毒。由于线虫与哺乳动物肠道细胞具有同源性,且其身体透明,因此被视为研究宿主体内肠道微生物相互作用的优良模型系统。
来自圣地亚哥州立大学Dalaena E Rivera等人提出了一种通过FISH检测秀丽隐杆线虫体内微生物的实验方案。通过 FISH技术可以分别标记感染秀丽线虫的奥赛病毒(Orsay virus)和微孢子虫的18S rRNA,从而得到病毒及微生物在肠道中感染或定植的空间分布,以此来表征宿主-微生物和微生物-微生物的作用关系。接下来小编将为大家详细介绍FISH技术的应用及其优缺点。


线虫RNA FISH的实验方法
RNA FISH详细的实验步骤主要包括:收集线虫——清洗线虫——固定线虫——准备杂交缓冲液——添加FISH探针孵育——洗掉探针——制片拍照(见图1)。可以用多聚甲醛溶液(PFA)或丙酮固定线虫。与丙酮相比,PFA能更好地观察线虫形态,并能保留转基因绿色荧光蛋白(GFP)的信号,而丙酮会破坏GFP。然而,丙酮固定是使微孢子虫孢子透化的必要条件,以便对这一生命阶段进行标记。此外,丙酮比PFA更方便,因为它的毒性更小,并且丙酮处理中的样品可以在-20℃冰箱中保存几天,而不需要移除固定剂。
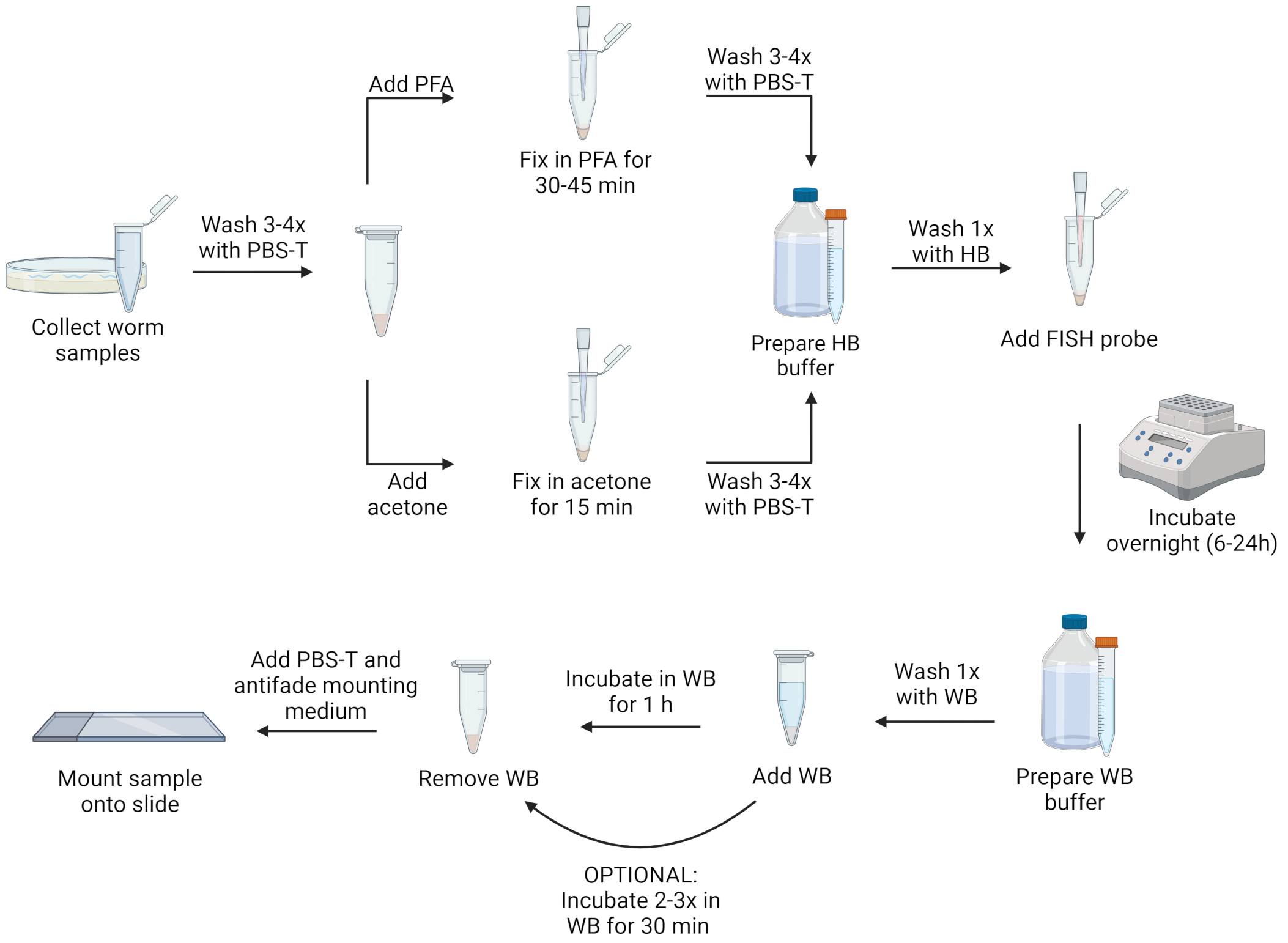
图1 FISH实验的可视化表示

线虫肠道内的细菌群分布
研究人员从野外分离了一株秀丽隐杆线虫JU1848,并选取了一个细菌16S rRNA的FISH探针对其体内细菌进行标记,通过DIC显微镜可以观察到一种定向粘附在肠上皮的细菌(见图2A),经鉴定,该细菌为肠杆菌科的一个新种。作者在实验中设计出针对该菌特异的16S rRNA探针Cal Fluor Red 610,将细菌标记为红色;同时添加了一种能够标记多种细菌为绿色的通用16S rRNA探针6-carboxyfluorescin(FAM)。结果显示两种颜色完全重合,证实了定植于肠道的大多数细菌是粘附的肠杆菌科细菌(见图2B)。
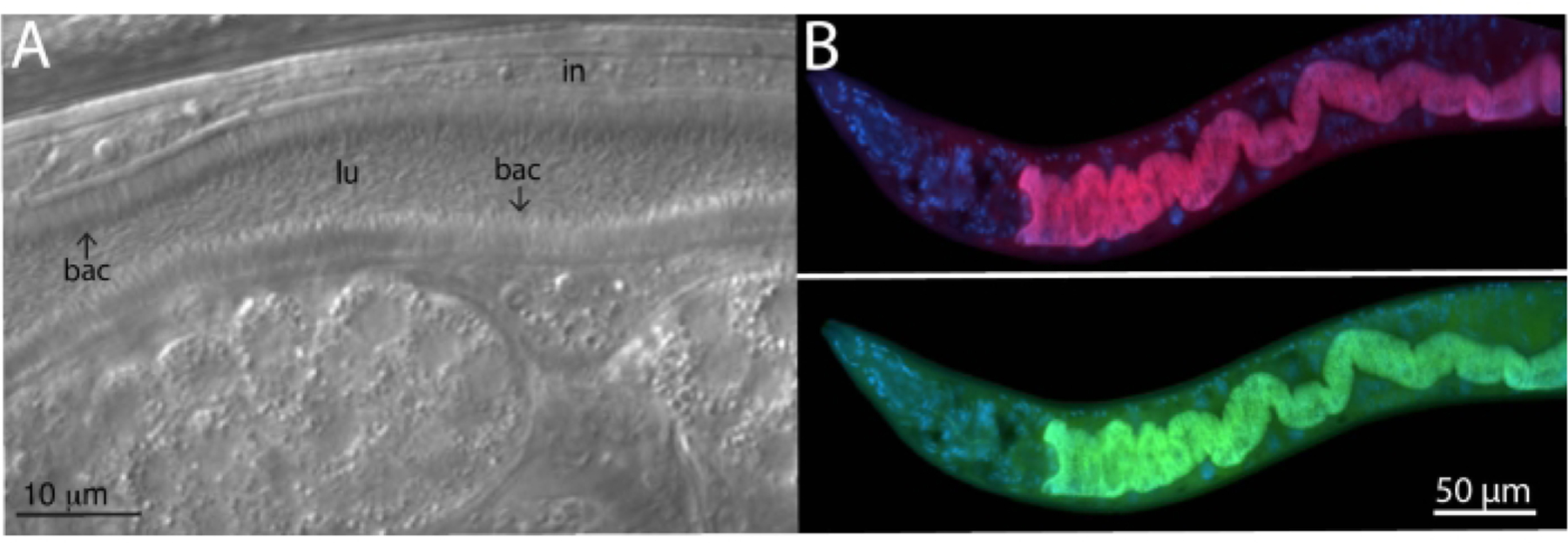
图2 对JU1848菌株进行FISH染色,观察其肠道内黏附菌定植情况

线虫肠道细胞的病毒及微孢子虫感染
文章选取奥赛病毒以观察细胞内病原体的实验性感染。奥赛病毒是一种来自结节病毒科的正链RNA病毒,也是唯一从秀丽隐杆线虫中发现的天然病毒。该病毒由RNA1和RNA2两段组成,作者设计了用于标记病毒为红色的靶向FISH探针,可清晰观察到病毒在细胞内的定位分布(见图3A)。病毒RNA是通过RIG-I同系物DRH-1进行检测的,它是激活细胞内病原体反应的转录防御程序(Intracellular Pathogen Response,简称IPR)的关键因素。作者通过绿色荧光蛋白定位调控抗病毒IPR线虫基因ZIP-1所在的细胞核,可见其细胞核呈现绿色,从而证实奥赛病毒分布调控IPR所在的细胞(见图3A)。作者进一步对多个线虫个体进行FISH标记,均呈现出奥尔赛病毒感染的情况(见图3B)。
为了探究通过FISH技术观察线虫体内寄生虫的感染状况,作者选用了微孢子虫——Nematocida parisii。N. parisii得名于其来源地巴黎,是一种专性肠道胞内病原体,对线虫危害极大。作者采用了MicroB和MicroF等 FISH探针,对N. parisii进行18S rRNA标记,可以观察到多个线虫体内均有微孢子虫的感染(见图3C)。此外,秀丽隐杆线虫还受到其他密切相关的微孢子虫感染。通过设计物种特异性的FISH探针标记,可以看见在野生型线虫中定位出两种病原微孢子虫(N. parisii和N. ausubeli),宿主线虫的细胞核此时被染成了蓝色,用于对比(见图3D)。为了观察N. parisii的孢子,必须将线虫固定在丙酮中,因为丙酮比PFA更能穿透孢子壁(见图3E.F),产生的FISH染色显示了大小不一的杆状结构,可能与N. parisii孢子相对应。
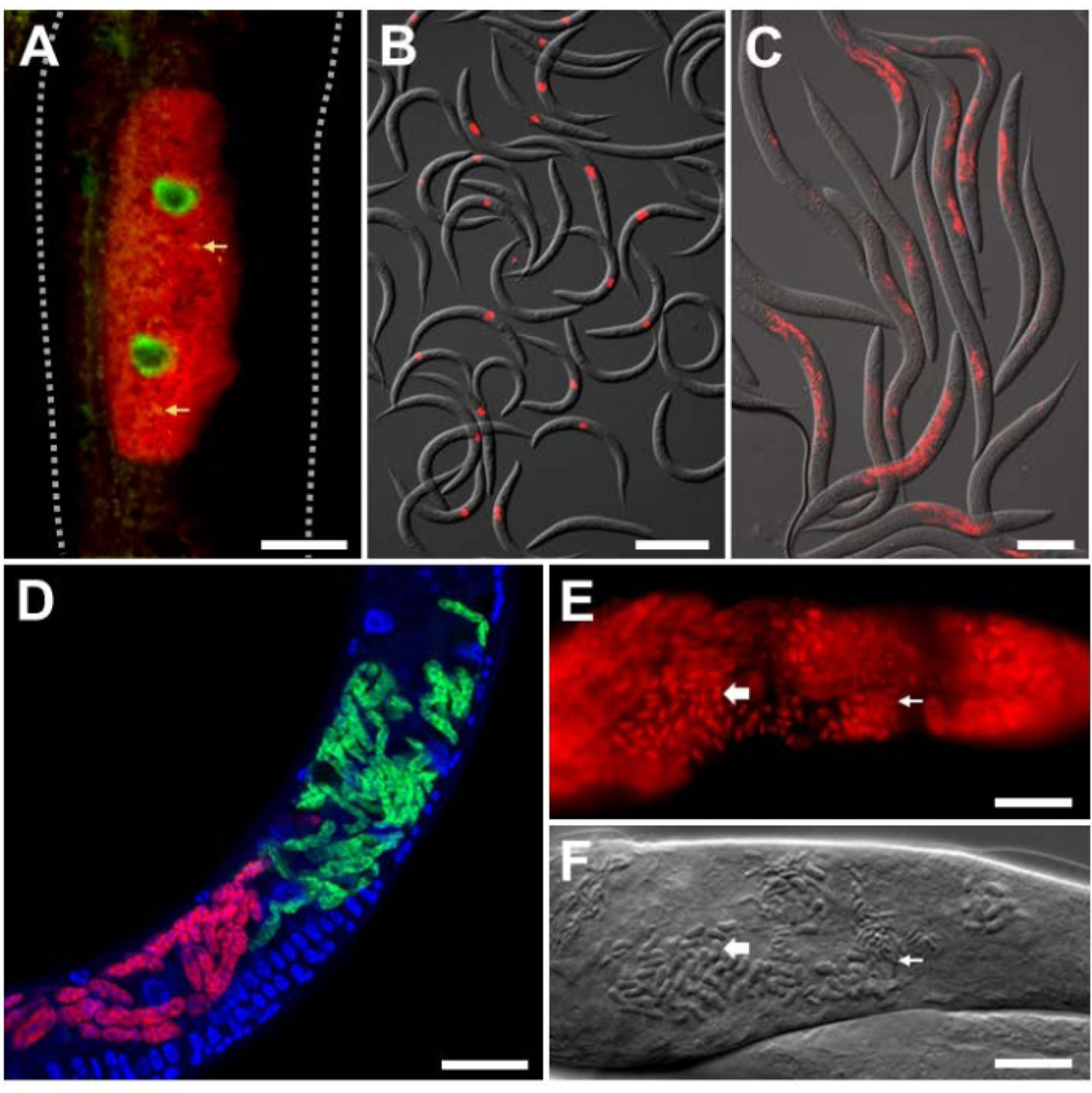
图3 线虫肠道细胞的微孢子虫感染

FISH实验的两个注意事项
在实验过程中,固定线虫环节至关重要。添加固定剂后一定的孵育时间是必要的,以便让试剂重复渗透线虫。但是,较长的孵育时间对于含有转基因荧光蛋白的样品来说并不适宜,因为固定剂PFA会随着时间的推移降解蛋白质。对于含有GFP的样品,必须确定最佳固定时间以保证透化的同时仍保持GFP信号。此外,对于微孢子虫孢子的染色,应该使用丙酮代替,因为PFA不能穿透孢子壁。使用丙酮和PFA固定的区别在于,丙酮更方便但会迅速杀死宿主中的任何现存的GFP,而PFA则可以更好地保持组织结构。该方案可以用于微生物感染的动态研究。
实验过程中的另一个重要环节为清洗。彻底清洗样品以去除多余微生物和探针,杂交后进行适当的洗涤可以减少背景荧光。在洗涤过程中,应密切关注洗涤温度和次数,通常情况下,洗涤温度比杂交温度高2°C,具体操作也要根据选择的探针来定。采用1mL WB进行两次或三次洗涤效果也明显要好于一次洗涤,既保证探针被有效清洗掉,同时背景荧光也会被最小化。

小编结语
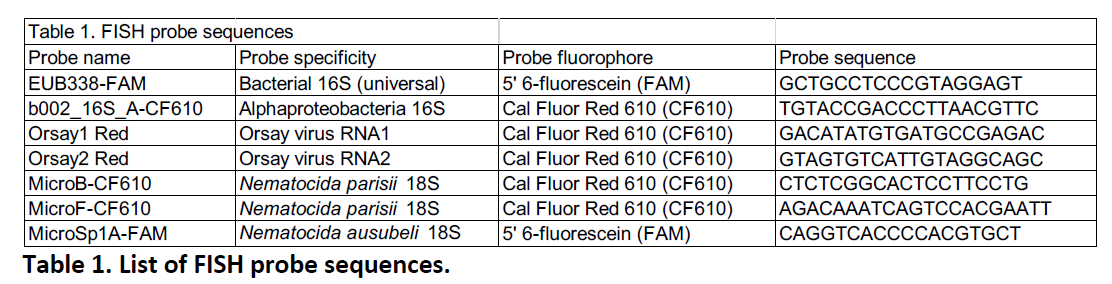
该方案提供了一种简单、快速、稳健的方法来染色与秀丽隐杆线虫相关的微生物。FISH探针靶向样品中丰富的小亚基核糖体RNA,能够获得高信噪比的图像。RNA FISH可以在整个动物环境中观察感染或定植情况,通过使用DAPI对宿主细胞核进行共染色和/或使用荧光标记的秀丽隐杆线虫菌株,更好地突出样品中感染或定植的定位。最后,附上作者选用的FISH探针序列,读者可以根据需要进行选用(见表1)
表1
撰稿:黄河
审核:陈岚彬
编辑;余雯

