
点击蓝字,关注我们
奥林匹克格言“更快、更高、更强——更团结”象征着人类不断追求卓越、永不满足的奋斗和拼搏精神。同样地,科学家在荧光蛋白研究领域,亦不懈地追求着“更亮、更稳定、单体”的突破。秀丽隐杆线虫作为荧光蛋白应用的先驱模式生物,为科研工作者提供了宝贵的实验素材。上源生科也曾系统总结了在线虫中使用过的部分荧光蛋白,以期为后来的研究者提供有益的参考。(传送门:上源教你如何应用荧光蛋白进行秀丽线虫研究)
最近,中国西湖大学和俄罗斯科学院等多所院校合作,成功开发出了一种新的绿色荧光蛋白单体——mBaojin(意为“保金”,取自英文StayGold的直译)[1]。mBaojin是由其前体蛋白StayGold(一种野生型Ceratocystis uchidae水母中的绿色荧光蛋白)改造获得的(图1,除了mBaojin外,最近还有两篇文章也对StayGold进行单体化改造,其分别为StayGold-E138D[2]和mStayGold及mStayGold2[3])。但由于StayGold会形成二聚体,因此限制了其在蛋白荧光标签、膜定位标签以及生物传感器等方面的应用。因此,科研团队需要对StayGold进行改造使其呈现出更好的单体化,同时保留其前体的有益特征。

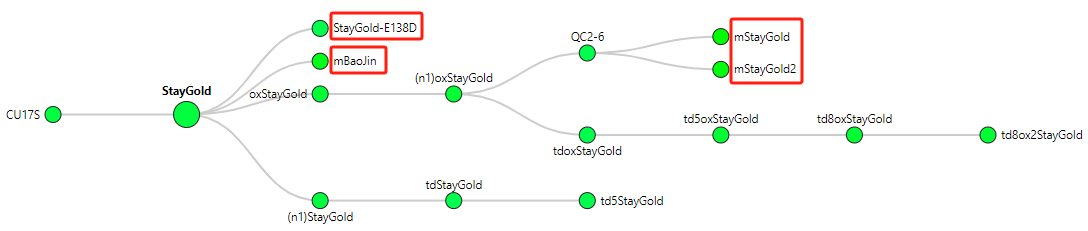
图1 Ceratocystis uchidae中的绿色荧光蛋白改造的过程
单体StayGold筛选过程
文章中为了促进在细菌中筛选单体StayGold,作者巧妙地运用了DNA结合结构域蛋白AraC(AraCDNA)与荧光蛋白融合(StayGold::AraCDNA)的策略。简单地说,由鼠李糖启动子控制表达的StayGold::AraCDNA中,StayGold若表现出二聚体性,那么StayGold::AraCDNA就会以二聚体形式结合在果胶糖启动子上,从而引起更多报告基因mTagBFP的转录翻译;但StayGold::AraCDNA中StayGold若表现出单体性,那么在果胶糖启动子就只有单体结合,导致报告基因mTagBFP产生的蓝色荧光信号显著减弱(图2)。
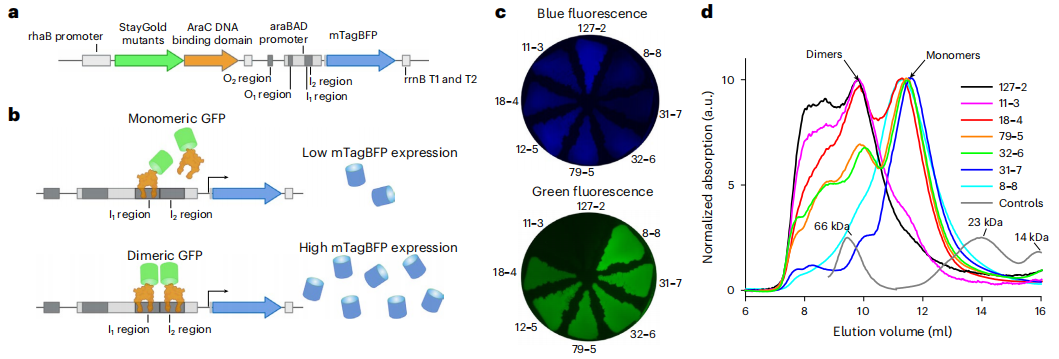
图2 筛选单体StayGold流程原理
在每轮随机突变筛选过程中,作者挑选蓝色荧光信号比较暗而绿色荧光信号最亮的菌落,并通过快速蛋白液相色谱(fast protein liquid chromatography,FPLC)技术确认它们的单体性。经过八轮定向进化后,成功确定了一种亮度最高的绿色荧光蛋白单体,同时在该单体上添加mNeonGreen蛋白的N端和C端作修饰,以确保其在哺乳动物细胞中稳定表达,并将其名为mBaoJin(图3)。mBaoJin在高浓度下有大约99%呈现出单体性,高于mNeonGreen(95%),而其前体StayGold并没有表现出单体性。此外,在与其他荧光蛋白的比较中,mBaoJin在吸收和荧光光谱特性、亮度、光稳定性、成熟时间和pH稳定性等多个关键参数上均有良好表现。

图3 mBaoJin与StayGold氨基酸序列比较
mBaoJin在线虫中的表现
福建上源生科协助该文章作者完成游离型线虫品系的编辑工作。得到的游离型线虫用于在绿色通道中评估荧光蛋白的细胞内定位、亮度和光稳定性。为确保荧光蛋白在线虫体内的高效表达,作者使用在线线虫密码子调试器,对编码DNA序列进行了优化,在其中插入两个合成的内含子。将由tag-168泛神经元启动子表达的绿色荧光蛋白质粒注射到野生型N2背景线虫中。实验结果显示,在线虫神经元中,mBaoJin荧光蛋白的细胞内亮度相较于mNeonGreen荧光蛋白显著提高了约两倍(图4a-c)。在持续的照明条件下,mBaoJin展现出了优异的光稳定性,其光漂白率较于mNeonGreen 降低了四倍,即便经过长达15分钟的持续照射,仍保留超过50%的初始荧光值(图4d)。这些结果充分证明了mBaoJin荧光蛋白在线虫神经元中不仅具有高亮度的特点,而且具有出色的光稳定性,为后续的荧光成像和生物标记研究提供了有力的工具。
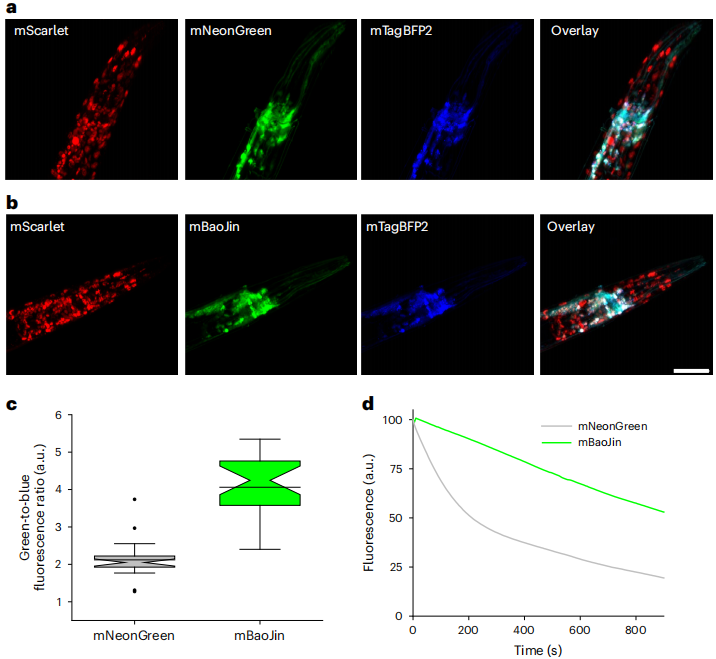
图4 mNeonGreen和mBaoJin在线虫神经元中的特性
参考文献
[1] Zhang, Hanbin, et al. Bright and stable monomeric green fluorescent protein derived from StayGold. Nature Methods, 2024, 1-9. Doi:10.1038/s41592-024-02203-y
[2] Ivorra-Molla, Esther, et al. A monomeric StayGold fluorescent protein. Nature Biotechnology 2023, 1-4. Doi:10.1038/s41587-023-02018-w
[3] Ando, Ryoko, et al. StayGold variants for molecular fusion and membrane-targeting applications. Nature Methods, 2023, 1-9. Doi:10.1038/s41592-023-02085-6
撰稿:卞文印
审核:陈岚彬
编辑:余雯

