
点击蓝字 关注我们
2024年10月7日维克托·安布罗斯(Victor Ambros)和加里·鲁夫昆(Gary Ruvkun),因发现microRNA及其在转录后基因调控中的作用,荣获诺贝尔生理学或医学奖。自1993年,维克托·安布罗斯和加里·鲁夫昆在秀丽隐杆线虫中发现了第一个miRNA——lin-4后,他们和其他科学家陆续发现了更多的miRNA,并揭示了miRNA在基因调控中的重要作用。本次,小编将借助“Recent advances in understanding microRNA function and regulation in C. elegans”这篇文章,带大家来认识microRNA的功能。

首先,我们对miRNA做一个简单的回顾了解。
microRNAs(miRNAs)是一种小的非编码RNA(~22nt),是后生动物中转录后基因表达的重要调控因子。装载miRNAs的Argonaute蛋白与许多其他蛋白相互作用,形成miRNA诱导的沉默复合物(miRISCs),它能够通过翻译抑制或降解miRNAs的靶点。miRISC的关键组成部分之一是支架蛋白GW182,它与Argonaute蛋白、poly-A结合蛋白和去烯化复合物相互作用。GW182被招募到目标mRNA上,导致靶mRNA的翻译抑制和衰减。一些Argonaute蛋白具有核糖内切酶功能,使它们能够直接切割靶标,如植物miRNA与靶标的相互作用;然而,这一现象在动物miRNAs中并不具有典型性。
miRNAs源于母体,在发育早期表达,在每个动物组织中都有发现。因此,基于miRNA的基因调控很可能影响细胞发育和功能的几乎每个方面。miRNA家族成员的功能冗余性使得很难确定单个miRNA对基因表达的确切贡献。基于3’utr的种子互补性和结合位点保守的miRNA靶点的生物信息学预测表明,单个miRNA调控数百个基因;然而,验证miRNA-靶点相互作用却是一个持续性的挑战。
在秀丽隐杆线虫中,多个Argonaute蛋白与miRNA相关。ALG-1、ALG-2、ALG-5和RDE-1是与miRNA结合最明显相关的Argonaute,它们是维持与其相关的miRNA稳定性所必需的。在这些Argonaute蛋白中,ALG-1和ALG-2具有基本相似的氨基酸序列,在体细胞组织中表达模式大多重叠。在性腺和头部神经节的一些神经元中仅表达ALG-2,而咽部主要表达ALG-1。ALG-5的表达仅限于性腺,对野生型线虫的生育能力至关重要。RDE-1启动子在性腺和体细胞组织中都具有活性。
单个miRNAs在Argonaute蛋白中差异富集;大多数miRNAs被装载到ALG-1、ALG-2和RDE-1中,而一小部分的miRNAs被优先装载到ALG-5中。将miRNA加载到RDE-1中的决定因素之一是pre-miRNA序列中错配碱基对的数量;RDE-1结合的miRNA具有更少的错配碱基对。许多与RDE-1结合的miRNAs在线虫物种中并不保守,这表明最近进化的miRNAs与RDE-1相关。ALG-1、ALG-2冗余地执行最基本的miRNA功能;这两个基因的失活都是致命的。RDE-1的关键功能在于它能够响应外源性的双链RNA(dsRNA)信号,从而触发RNA干扰(RNAi)过程。
最初发现的miRNAs在线虫中的作用是调节幼虫期之间过渡所需的基因表达变化。随后,miRNAs被证明可以调节神经元的左右不对称性、RNAi 、衰老、进入dauer期、生殖、性别决定、先天免疫系统等许多其他过程。尽管大多数miRNA家族在基因调控中具有广泛的作用,但它们对线虫的胚胎发育并不是必需的。只有mir-51和mir-35的miRNA家族对胚胎发生是必不可少的。
接下来,让我们一起详细了解一下miRNA的具体功能吧。
1
miRNA对胚胎发育的影响

mir-35家族是研究最多的miRNA家族之一,有一些已验证的靶点,包括egl-1、sup-26、nhl-2和ndk-1。mir-35对sup-26的调控影响了胚胎对缺氧环境的反应能力,而sup-26和nhl-2在性别决定通路中mir-35-42的下游起重要作用。在性腺中,mir-35介导的egl-1和ndk-1的抑制,可限制由DNA损伤引发的凋亡。通过multiplexed CRISPR筛选(图1F),确定egl-1是mir-35的一个关键靶点:单独抑制egl-1会导致中度胚胎致死率和降低生殖力。尽管这些研究一致表明了egl-1的重要性,但它们同时也揭示了mir-35家族中尚有其他关键靶点未被确定。尽管CRISPR技术可能会在未来拓展我们对该家族靶点认知的边界,但目前已知的是,对于mir-51家族而言,cdh-3和glo-4是其关键靶点。
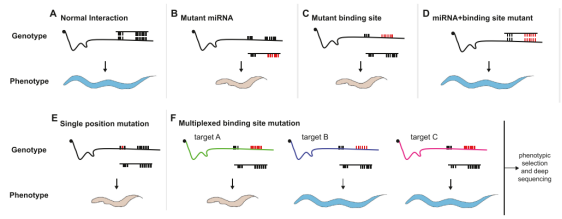
图1 通过CRISPR技术对miRNA靶点进行鉴定和验证
2
miRNA对幼虫发育的影响

miRNAs lin-4和let-7在调控发育时序上发挥着至关重要的作用。通过深入探索它们所调控的基因网络,我们发现let-7通过调控lin-41,参与了多个性别特异性发育的过程。其一,对lin-41的抑制及对下游靶点的激活,引导表皮发育的时空顺序和vulva的完整性;其二,通过激活特定的雄性特异性lin-41靶点来指导雄性性器官的发育。在神经系统方面,一些神经元性别二型性的产生也是由let-7对lin-41的性别特异性作用的抑制所介导的。在PVD神经元中,lin-4和let-7的作用分别决定了树突分枝开始和结束的时间。
mir-48,mir-84和mir-241作为let-7的姐妹,在调控hbl-1以促进L2幼虫向L3幼虫发育的过程中扮演着关键角色。它们通过LIN-46来调节HBL-1的亚细胞定位,协助完成对HBL-1的抑制。然而,对于dauer的形成,这种依赖于LIN-46、不依赖于miRNA的hbl-1抑制(通过DAF-12通路)显得尤其重要。
3
应激反应中miRNA的作用

通过miRNA进行转录后基因调控,可以快速响应变化的条件。同样,许多应激条件也会造成miRNA表达的变化,比如尼古丁暴露,氧化应激,热应激,饥饿,病原体感染等。
最近的研究主要集中在热应激情况下miRNA的作用。热应激导致大多数miRNA的下调,这种下调与ALG-1水平的降低相一致。然而,特定的miRNAs受到选择性的影响(表1),热应激反应中的某些miRNAs突变体,在暴露于热应激条件下时其寿命和运动性下降(图2)。

表1 受热应激调控的19个miRNA
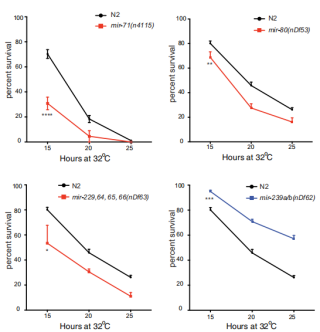
图2 热激情况下,miRNA缺失突变体对寿命的影响
此外,据了解HSP-70在热应激过程中被上调100倍,在热应激恢复过程中,需通过mir-85下调HSP-70的表达量,线虫才能获得最佳生存能力(图3)。
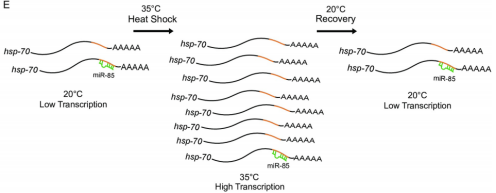
图3 mir-85在调节hsp-70中的作用模型
4
衰老过程中miRNA的作用

秀丽隐杆线虫是研究衰老的一种极好的模型生物,因为它们的寿命相对较短,有明确的衰老表型,如生育能力和运动性能下降,以及神经退行性变。早期的研究表明,miRNA lin-4除了在幼虫发育中发挥良好的作用外,还能延长寿命。
最近的研究表明,突变alg-1或alg-2导致相反的衰老表型;alg-1的突变导致寿命缩短,而alg-2的突变增加寿命。ALG-1的表达水平在L4期之后下降,而ALG-2的表达水平在整个成年期保持不变。在衰老的线虫中,ALG-1的下调至少部分是由于mir-71介导的,mir-71在衰老的线虫中表达增加,并靶向alg-1的3’UTR。
衰老的特征之一是自噬的广泛减少,这在较长寿的突变体中以组织特异性的方式被阻止。Zhou等人在2019年发表的研究中表明,miRNA是调节组织特异性自噬的机制之一。具体来说,mir-83在神经元和肠道中表达,并在衰老过程中在肠道中表达增加。mir-83的表达是由hsf-1诱导的,hsf-1在衰老线虫的肠道中上调,而mir-83突变的线虫增加了肠道自噬和寿命(图4)。自噬相关基因cup-5(调节肠道自噬)被确定为mir-83靶点。
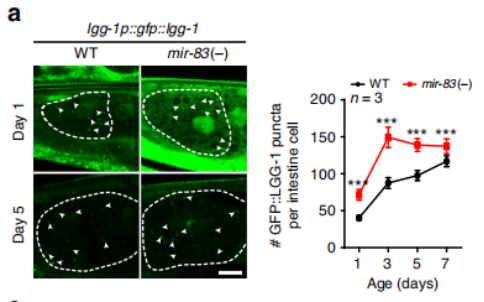
图4 mir-83调节肠道内的自噬(箭头指示肠道内自噬体)
5
组织特异性miRNA的作用

miRNAs的组织特异性作用与发育、免疫反应、蛋白稳态、运动、代谢、生育和行为密切相关。最近的一项研究应用了一种基于免疫沉淀的方法来识别体壁肌肉、神经元和肠道中的组织特异性miRNA靶点。剪接因子在这些组织之间受到miRNA的差异调控,miRNA活性对组织特异性选择性剪接有一定影响(图5)。
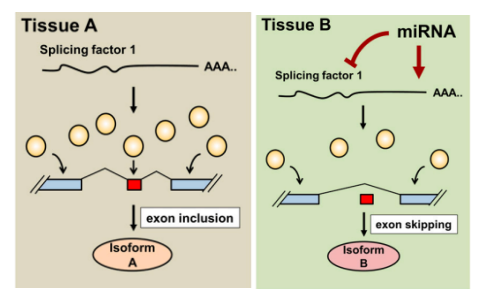
图5 miRNA在调节组织特异性选择性剪接中的作用。
RNA剪接因子(黄色圆圈)的丰度决定了tissue A中的剪接事件。tissue B中存在miRNA可能会降低这些剪接因子的剂量,从而导致组织特异性选择性剪接。
miRNA表达的精细组织特异性往往决定了其功能。例如mir-791,它在三对负责检测二氧化碳和逃逸行为的神经元中特异性表达。mir-791通过对其靶基因akap-1和cah-3的调控,使线虫能够对CO2产生相应的反应行为。
mir-71的长寿作用大部分是由于其对AWC神经元中的桥和白细胞介素受体tir-1的调控。敲除tir-1 mRNA中的mir-71结合位点,可以复现mir-71突变体的表型(破坏蛋白稳态,缩短寿命)。mir-71在AWC中调控tir-1,是通过神经肽信号传导到肠道,改变蛋白稳态以应对不同的食物来源。
另一个组织特异性miRNA是mir-1,它在肌肉细胞中特异性表达。mir-1能调节体壁肌肉的自噬,mir-1功能缺失线虫呈现poly-Q的积累增加,α-突触核蛋白聚集,以及对热应激的敏感性增加(图6)。mir-1对肌肉自噬的影响是由Tre-2/Bub2/CDC16(TBC)Rab GTPase激活蛋白TBC-7介导的,该蛋白在体壁肌肉细胞中的过表达导致mir-1功能丧失。
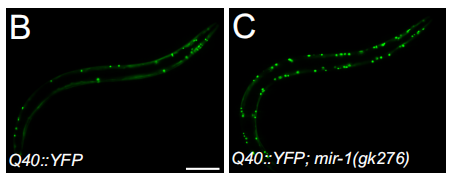
图6 mir-1功能缺失诱导poly-Q的聚集增加
mir-44家族的miRNA家族对线虫的生育能力至关重要。这个miRNA家族的单个突变体增加了胚胎和成虫的致死率。该家族多个成员突变的线虫,由于精子产量减少导致排卵率下降。精子产量的减少,与精子产生开始的延迟以及精子产生的过早结束有关。然而,其确切的发生机制尚未清晰。
小结

线虫中的miRNA具有多种重要功能,这些功能主要体现在对基因表达的调控上,并涉及多种生物过程。虽然目前关于线虫中miRNA与疾病关系的研究相对较少,但已有研究表明miRNA失调与多种人类疾病相关。因此,研究线虫中的miRNA也可能为理解人类疾病的发生和发展提供新的线索。随着研究的深入,我们有望更加全面地了解miRNA在线虫以及其他生物体中的功能和作用机制。
参考文献:
[1] Kotagama K, McJunkin K. Recent advances in understanding microRNA function and regulation in C. elegans. Semin Cell Dev Biol. 2024 Feb 15;154(Pt A):4-13. doi: 10.1016/j.semcdb.2023.03.011. Epub 2023 Apr 11. PMID: 37055330; PMCID: PMC10564972.
[2] Zhou Y, Wang X, Song M, He Z, Cui G, Peng G, Dieterich C, Antebi A, Jing N, Shen Y. A secreted microRNA disrupts autophagy in distinct tissues of Caenorhabditis elegans upon ageing. Nat Commun. 2019 Oct 23;10(1):4827. doi: 10.1038/s41467-019-12821-2. PMID: 31645592; PMCID: PMC6811558.
[3] Kotagama K, Schorr AL, Steber HS, Mangone M. ALG-1 Influences Accurate mRNA Splicing Patterns in the Caenorhabditis elegans Intestine and Body Muscle Tissues by Modulating Splicing Factor Activities. Genetics. 2019 Jul;212(3):931-951. doi: 10.1534/genetics.119.302223. Epub 2019 May 9. PMID: 31073019; PMCID: PMC6614907.
[4] Nehammer C, Ejlerskov P, Gopal S, Handley A, Ng L, Moreira P, Lee H, Issazadeh-Navikas S, Rubinsztein DC, Pocock R. Interferon-β-induced miR-1 alleviates toxic protein accumulation by controlling autophagy. Elife. 2019 Dec 4;8:e49930. doi: 10.7554/eLife.49930. PMID: 31799933; PMCID: PMC6914338.
[5] Pagliuso DC, Bodas DM, Pasquinelli AE. Recovery from heat shock requires the microRNA pathway in Caenorhabditis elegans. PLoS Genet. 2021 Aug 5;17(8):e1009734. doi: 10.1371/journal.pgen.1009734. PMID: 34351906; PMCID: PMC8370650.
[6] Nehammer C, Podolska A, Mackowiak SD, Kagias K, Pocock R. Specific microRNAs regulate heat stress responses in Caenorhabditis elegans. Sci Rep. 2015 Mar 9;5:8866. doi: 10.1038/srep08866. Erratum in: Sci Rep. 2019 May 20;9(1):7619. doi: 10.1038/s41598-019-43688-4. PMID: 25746291; PMCID: PMC4352874.
撰稿:郑惠
审核:陈岚彬
编辑:余雯